
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры
|
|
Зависимость константы равновесия от температуры 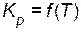 выражается уравнением
выражается уравнением
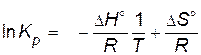 , или , или 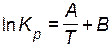 , ,
| (4.4) |
где 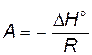 ;
; 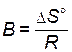 .
.
Выражение (4.4) представляет собой уравнение прямой в координатах 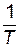 —
— 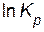 , тангенс угла наклона которой к оси абсцисс
, тангенс угла наклона которой к оси абсцисс 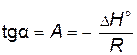 , а отрезок, отсекаемый на оси ординат,
, а отрезок, отсекаемый на оси ординат, 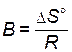 (рис. 11).
(рис. 11).
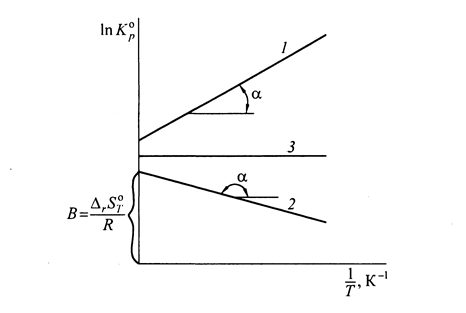
Рис. 11. Зависимость логарифма константы равновесия от обратной
абсолютной температуры для разных типов реакции:
1 – экзотермическая (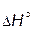 < 0); 2 – эндотермическая (
< 0); 2 – эндотермическая (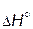 > 0);
> 0);
3 – реакция с нулевым тепловым эффектом (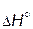 = 0)
= 0)
Для экзотермической реакции (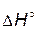 < 0,
< 0, 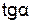 > 0) угол наклона прямой к оси абсцисс положителен, для эндотермических процессов (
> 0) угол наклона прямой к оси абсцисс положителен, для эндотермических процессов (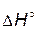 > 0,
> 0, 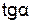 < 0) отрицателен, для реакций с нулевым тепловым эффектом (
< 0) отрицателен, для реакций с нулевым тепловым эффектом (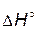 = 0,
= 0, 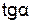 = 0) равен 0 (рис. 11, прямые 1, 2, 3 соответственно).
= 0) равен 0 (рис. 11, прямые 1, 2, 3 соответственно). 

1. Для экзотермических процессов 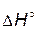 < 0 при увеличениии температуры значения
< 0 при увеличениии температуры значения 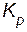 уменьшаются, что соответствует смещению равновесия в сторону обратной (эндотермической) реакции.
уменьшаются, что соответствует смещению равновесия в сторону обратной (эндотермической) реакции.
Например, для реакции синтеза аммиака из азота и водорода
N2(г) + 3H2 (г) 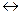 2NH3(г),
2NH3(г),
которая является экзотермической (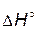 < 0), первое слагаемое в уравнении (4.4) будет положительным. С повышением температуры его абсолютная величина будет уменьшаться. Это приведет к уменьшению
< 0), первое слагаемое в уравнении (4.4) будет положительным. С повышением температуры его абсолютная величина будет уменьшаться. Это приведет к уменьшению 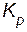 независимо от знака
независимо от знака 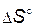 .
.
Уменьшение 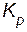 означает, что в выражении константы равновесия числитель (концентрации продуктов реакции) уменьшается, а знаменатель (концентрации исходных веществ) увеличивается.
означает, что в выражении константы равновесия числитель (концентрации продуктов реакции) уменьшается, а знаменатель (концентрации исходных веществ) увеличивается.
Равновесие смещается в сторону обратного эндотермического процесса разложения аммиака.
2. Для эндотермических процессов 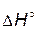 > 0 при увеличении температуры значения
> 0 при увеличении температуры значения 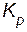 увеличиваются, что соответствует смещению равновесия в сторону прямой (экзотермической) реакции.
увеличиваются, что соответствует смещению равновесия в сторону прямой (экзотермической) реакции.
Например, в реакции
N2O4 (г) «2 NO2 (г), 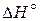 = 57, 4 кДж.
= 57, 4 кДж.
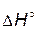 > 0, т.е. прямая реакция - эндотермическая. Следовательно, первое слагаемое в уравнении (4.4) отрицательно. При увеличении температуры его абсолютная величина уменьшается и независимо от знака
> 0, т.е. прямая реакция - эндотермическая. Следовательно, первое слагаемое в уравнении (4.4) отрицательно. При увеличении температуры его абсолютная величина уменьшается и независимо от знака 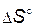 константа увеличивается.
константа увеличивается.
Увеличение 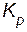 означает, что в выражении константы равновесия числитель (концентрации продуктов реакции) увеличивается, а знаменатель (концентрации исходных веществ) уменьшается. Равновесие смещается в сторону прямой реакции.
означает, что в выражении константы равновесия числитель (концентрации продуктов реакции) увеличивается, а знаменатель (концентрации исходных веществ) уменьшается. Равновесие смещается в сторону прямой реакции.
Зная знак 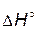 , можно сказать, в каком направлении будет изменяться константа равновесия при изменении температуры.
, можно сказать, в каком направлении будет изменяться константа равновесия при изменении температуры.
Повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты и охлаждением системы, т.е. в сторону эндотермической реакции.
При понижении температуры равновесие смещается в сторону экзотермической реакции.