
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Работа 4. Изучение кинетики реакции омыления уксусноэтилового эфира щелочью методом потенциометриии
|
|
Реакция омыления уксусноэтилового эфира протекает по уравнению
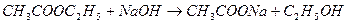
Данная реакция практически необратима, протекает с заметной скоростью и является реакцией второго порядка. В общем случае выражение для скорости этой реакции можно записать
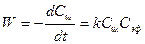
Для определения частного порядка реакции по гидроксид-иону и константы скорости применяется " метод избытка реагента". При избытке эфира уравнение для константы скорости будет иметь вид
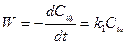 ,
,
где 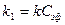 , и кинетика этой реакции будет подчиняться кинетике реакции первого порядка, а выражение для константы скорости будет
, и кинетика этой реакции будет подчиняться кинетике реакции первого порядка, а выражение для константы скорости будет
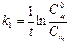 (1)
(1)
В данной работе концентрация щелочи определяется методом потенциометрии. В качестве индикаторного используется стеклянный электрод. Потенциал стеклянного электрода зависит от активности ионов водорода:
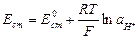 (2)
(2)
Активность ионов водорода связана с активностью гидроксид-ионов
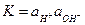 (3)
(3)
где 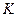 - ионное произведение воды, величина постоянная при заданной температуре. Из уравнения (3) находим концентрацию ионов водорода и подставляем в (2):
- ионное произведение воды, величина постоянная при заданной температуре. Из уравнения (3) находим концентрацию ионов водорода и подставляем в (2):
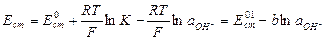 ,
,
где 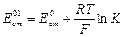 ;
; 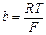
Таким образом, мы установили, что потенциал стеклянного электрода линейно зависит от концентрации гидроксид-ионов.
Составим гальваническую цепь из стеклянного электрода и электрода сравнения, погруженных в исследуемый раствор. В работе в качестве электрода сравнения используется насыщенный хлоридсеребряный электрод (ХСЭ). Измеряемая ЭДС такой цепи будет равна
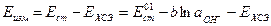
Из этого уравнения находим концентрацию гидроксид-ионов
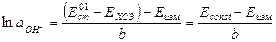
и подставляем в уравнение (1)
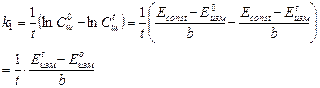 (4),
(4),
где 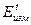 - разность потенциалов в момент времени t от начала опыта, а
- разность потенциалов в момент времени t от начала опыта, а 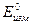 - в начальный момент времени.
- в начальный момент времени.
Константу скорости реакции вычисляем по уравнению
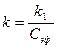 (5)
(5)
Для определения 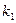 графическим методом уравнение (4) запишем в виде
графическим методом уравнение (4) запишем в виде
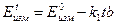
Т.е. по тангенсу угла наклона прямой в координатах 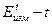 можно оценить
можно оценить 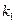 , а затем по уравнению (5) найти константу скорости реакции. Зная константы скорости при двух температурах Т1 и Т2 можно вычислить энергию активации Еа по уравнению
, а затем по уравнению (5) найти константу скорости реакции. Зная константы скорости при двух температурах Т1 и Т2 можно вычислить энергию активации Еа по уравнению
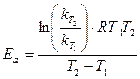 (6)
(6)