
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость гомогенных химических реакций.
|
|
КИНЕТИКА ГОМОГЕННЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ
В гомогенных процессах все реагирующие компоненты находятся в одной фазы: будь то газ, жидкость или твердое вещество. При каталитической реакции катализатор тоже должен находиться в той же фазе, что и реагирующие вещества.
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Цель кинетических расчетов установить кинетическую модель реакции.
Для получения кинетической модели первоначально проводят кинетический эксперимент, суть которого заключается в нахождении зависимости концентрации реагирующих веществ (продуктов реакции) от времени при различных условиях.
Скорость гомогенных химических реакций.
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
1 1 d n i
Vr = 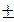 ----- × ----- × ----- (3.1)
----- × ----- × ----- (3.1)
n i V d t
Если реакция протекает без изменения объема, то скорость реакции можно выразить через концентрацию реагентов:
1 d С i
Vr =  ----- × ----- (3.2)
----- × ----- (3.2)
n i d t i
Различают истинную и среднюю скорость. Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δ t записывается следующим образом:
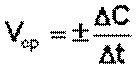 (3.3)
(3.3)
В различных интервалах времени средняя скорость химической реакции имеет разные значения;
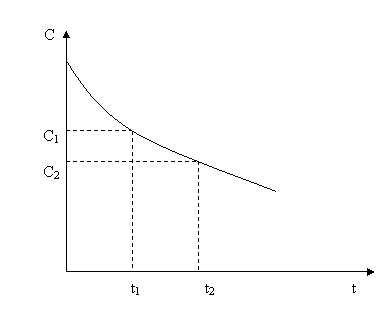 Рис. 3.1
Рис. 3.1
истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
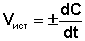 (3.4)
(3.4)
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рис.3.1).
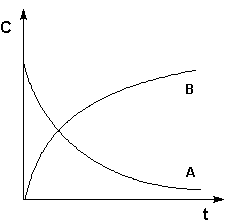
Рис. 3.2 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 3.3); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
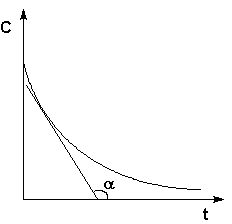
Рис. 3.3 Графическое определение Vист.
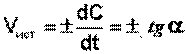 (3.4)
(3.4)
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось.
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.