
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общие закономерности окисления углеводородов
|
|
Процессы окисления ГСМ и специальных жидкостей молекулярным кислородом происходят при их длительном хранении, транспортировках, в различных условиях эксплуатации и определяют их основные эксплуатационные свойства: химическую и физическую стабильность, воспламеняемость, горючесть, склонность к нагаро- и лакообразованию, коррозионную агрессивность, охлаждающую способность и другие. Поэтому необходимо изучать и знать общие закономерности, механизмы окисления ГСМ в условиях эксплуатации и механизмы действия ингибиторов (катализаторов) окисления [3, 6-8, 11].
Окисление углеводородов обычно протекает по цепному механизму, а цепными называют химические реакции, в которых участвуют активные частицы: атомы, свободные радикалы и другие. В результате взаимодействия активных частиц с исходной молекулой углеводородов образуются новые активные частицы, реагирующие с исходными молекулами и так далее (по цепочке). При возникновении в реакционной смеси активной частицы происходит цепь химических превращений, в которой участвует большое количество исходных молекул. Цепная реакция продолжается до тех пор, пока существует активная частица, то есть до ее взаимодействия с другой активной частицей, материалом стенок сосуда, активными примесями и другими факторами. Цепные реакции, открытые М. Боденштейном в 1913 году, в результате которых при взаимодействии активной частицы с исходной молекулой образуется одна новая активная частица, называют неразветвленными.
В конце 20-х годов прошлого века Н.Н. Семеновым было установлено существование разветвленных цепных реакций, в которых взаимодействие одной активной частицы с исходной молекулой приводит к образованию новых активных частиц, а типичные разветвленные цепи можно представить схемой
Н  + О2
+ О2 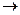
 ОН + О
ОН + О 
 О + Н2
О + Н2 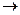
 ОН + Н
ОН + Н 
 ОН + Н2
ОН + Н2 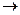 НОО
НОО  + Н2
+ Н2
возбуждение молекул
Если разветвление цепей происходит при каждом химическом акте, то скорость реакции лавинообразно возрастает и может привести к взрыву.
В начале 30-х годов прошлого века было установлено, что существуют химические цепные реакции, где разветвление осуществляется за счет диссоциации мало- (не) стабильных промежуточных продуктов. Эти цепные реакции назвали реакциями с вырожденным разветвлением, а окисление жидких углеводородов является типичным примером таких реакций. Процесс цепного окисления жидких углеводородов, в общем, состоит из следующих стадий: возбуждение молекул, зарождение активных центров, продолжение цепей, разветвление цепей и обрыв цепей. При газофазном окислении углеводородов, в зоне высоких температур, две первые стадии могут протекать слитно в одном элементарном акте. Поэтому стадию возбуждения молекул часто не рассматривают как самостоятельную, но она определяет скорость процесса окисления жидких углеводородов в целом.
Каждая стадия цепного процесса может включать несколько элементарных реакций, которые в большинстве хорошо изучены, и поэтому цепной процесс окисления углеводородов можно представить в виде следующей схемы
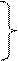 |
0) RH 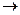 RH*
RH*
Зарождение цепей
0') 2RH* 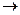 2R
2R  +H2
+H2 
0'') RH* + O2 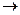 R
R  + HOO
+ HOO 
 |
1) R  + R'H
+ R'H 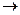 RH + R'
RH + R' 
Продолжение цепей
1') R  + O2
+ O2 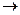 ROO
ROO 
2) ROO  + RH
+ RH 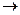 ROOH + R
ROOH + R 
 Вырождение,
Вырождение,
3) ROOH 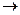 RO
RO  + HO
+ HO  разветвление цепей
разветвление цепей
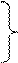 4) R
4) R  + R
+ R 
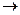 RR
RR
Обрыв цепей
5) ROO  + R
+ R 
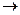 ROOR
ROOR
6) ROO  + ROO
+ ROO 
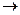 ROH + R'COR'' + O2
ROH + R'COR'' + O2
В связи с трудностями в решении сложных дифференциальных уравнений, описывающих скорость изменения концентрации каждого продукта во времени и пространстве, Н.А. Шиловым был предложен простой, приближенный способ определения скорости цепного процесса по методу выделения наиболее медленной реакции в цепном процессе. Если такая реакция существует, то ее скорость будет определять скорость процесса в целом. Так, скорость генерирования активных центров – свободных радикалов (скорость зарождения цепей) – часто является наиболее медленной стадией. В этом случае скорость образования i-го продукта в цепном процессе определится уравнением
ri = roiet/t, (3.1)
где roi – скорость генерации активных центров;
t – время реакции;
t – время жизни активного центра.
М. Боденштейн предложил метод приближенного определения скорости цепного процесса – метод стационарных концентраций, то есть если в цепном процессе быстро устанавливается равенство скоростей образования и гибели промежуточного продукта, то его концентрацию можно считать постоянной (стационарной):
C i = сonst, ri =  = 0. (3.2)
= 0. (3.2)
В этом случае из системы дифференциальных уравнений, описывающих цепной процесс, исключаются дифференциальные уравнения, определяющие скорость образования промежуточного продукта и решение задачи значительно упрощается.
Н.Н. Семенов расширил возможности метода стационарных концентраций, предложив при наличии в цепном процессе медленной стадии применить условия стационарных концентраций к остальным быстрым реакциям. В разветвленном цепном процессе такой медленной стадией обычно является реакция разветвления цепей. Если для реакций (1)–(6) принять условия стационарности концентраций и допустить, что концентрация кислорода в системе достаточно велика r1'> r0', [ROO  ] > > [R
] > > [R  ], а обрыв цепей происходит только по реакции (6) в схеме цепного окисления углеводородов, то скорость образования первичного стабильного продукта окисления – гидропероксида – можно вычислить по формуле
], а обрыв цепей происходит только по реакции (6) в схеме цепного окисления углеводородов, то скорость образования первичного стабильного продукта окисления – гидропероксида – можно вычислить по формуле
r ≈ K2[RH] 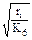 , (3.3)
, (3.3)
где К2 и К6 – константы скорости реакций (2) и (6).
Это уравнение приближенно описывает скорость окисления углеводородов с образованием гидропероксида в качестве конечного продукта, но при этом не учитывается влияние реакций вырожденного разветвления цепей на цепной процесс. Надежной количественной оценки скорости цепного окисления нет, а для использования известных способов оценки скорости цепного окисления необходимо детально изучить механизм цепного процесса и, прежде всего? механизм его наиболее медленных стадий – возбуждения молекул и зарождения цепей.
3.2 Механизм образования возбужденных молекул
при окислении газообразных углеводородов
При окислении углеводородов в газообразном состоянии, при отсутствии инициирования цепей (электромагнитным излучением или воздействием быстрых электронов), переход молекул в возбужденное состояние в объеме происходит в основном вследствие обмена энергий при соударениях молекул. Согласно распределению Максвелла, при соударении в газе молекул с высокими скоростями движения, часть кинетической энергии их поступательного движения передается колебательным степеням свободы в молекуле, которая переходит в возбужденное состояние. В жидкости молекулы переходят в возбужденное состояние с большей скоростью и при более низких температурах, чем в газах. Предполагают, что в жидкости происходит обмен колебательной энергии между молекулами и молекула переходит в возбужденное состояние за счет передачи части энергии межмолекулярного взаимодействия ее внутренним степеням свободы.
Дезактивирование возбужденных молекул может происходить: путем рассеяния энергии возбуждения вследствие передачи ее межмолекулярным степеням свободы; при взаимодействии возбужденной молекулы с молекулами, находящимися в основном состоянии; при межмолекулярном переносе энергии по обменному или резонансному механизмам; при химическом взаимодействии двух молекул, находящихся в возбужденном состоянии, но при этом возможна необратимая реакция с образованием свободных радикалов. В основе рассмотренного механизма перехода молекул жидкости в возбужденное состояние лежат процессы локальной самоорганизации структуры жидкости, обусловленные самопроизвольно протекающими в жидкости флуктуациями. Такой механизм возбуждения молекул в жидких углеводородах и их смесях изучает научная дисциплина – синергетика, которая исследует процессы самоорганизации в различных системах.
Кроме того, в объеме жидкости и газа существует возможность образования возбужденных молекул по гетерогенному механизму, так как хемосорбция молекул углеводорода на металлических поверхностях часто сопровождается реакциями переноса электронов по схеме
Меn+ + RH 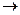 Ř H+ + Me(n-1)+, (3.4)
Ř H+ + Me(n-1)+, (3.4)
где ион-радикал Ř H+ – активная форма молекулы углеводорода.
Аналогично на оксидах металлов сорбируются молекулы кислорода и на поверхности металла образуются отрицательно заряженные ион-радикалы кислорода по схеме
Меn+ + О2 → Ǒ 2- + Me(n-1)+
Энергия передачи электрона от молекулы адсорбированного углеводорода металлу составляет 1–1, 5 эВ, а в присутствии кислорода, сорбированного на металле, энергия, необходимая для переноса электрона по реакции (3.4), существенно уменьшается. Это очень важно для реализации гетерогенного механизма возбуждения молекул и зарождения цепей при окислении углеводородов.