
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Особенности газофазного окисления углеводородов
|
|
Окисление углеводородов в газовой фазе обычно протекает при достаточно высоких температурах (более 200º С), а при высокотемпературном окислении вероятность зарождения цепей по гетерогенному механизму, протекающему с более высокой энергией активации, больше, чем по гомогенному. В условиях высоких температур образующиеся свободные радикалы становятся нестабильными и разлагаются до того, как они прореагируют с молекулой углеводорода. Поэтому становятся возможными реакции продолжения цепей, а распад алифатических радикалов приводит к образованию непредельных углеводородов (CnH2n). Роль гидропероксида, промежуточного продукта, обусловливающего реакцию вырожденного разветвления цепей, при высокотемпературном окислении снижается, а основными веществами, ответственными за реакции вырожденного разветвления цепей, становятся альдегиды, образующиеся по схемам
HCHO + O2  HCO
HCO  + HOO
+ HOO 
CH3–CHO + O2  CH3–Č O + HOO
CH3–Č O + HOO 
CH3–Č O  Č H3 + CO
Č H3 + CO
Определяющее влияние на стабильность образующихся свободных радикалов и направление окислительного процесса в целом оказывают температура, давление, состав смеси и химические свойства углеводородов. Так, для пропана, с ростом температуры в интервале
320–360º С, скорость реакции уменьшается, а при температурах
360–390º С снова возрастает. Это объясняется изменением с температурой механизма реакций вынужденного разветвления: предполагают, что в области температур ниже 320º С разветвление цепей идет преимущественно по реакции
ROO  +
+ 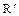 CHO
CHO 
 RO
RO  +
+  ОН +
ОН + 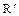 Č O,
Č O,
а при более высоких температурах становится возможным зарождение цепей по реакции
ROO 

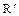 CHO +
CHO + 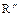 O
O  ,
,
протекающей с более высокой энергией активации (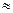 84 кДж/моль), но при этом снижается равновесная концентрация радикалов ROO
84 кДж/моль), но при этом снижается равновесная концентрация радикалов ROO  и уменьшается скорость окисления. Дальнейшее повышение температуры приводит к росту вероятности зарождения цепей по реакции
и уменьшается скорость окисления. Дальнейшее повышение температуры приводит к росту вероятности зарождения цепей по реакции
RCHO + O2  RČ O + HOO
RČ O + HOO  ,
,
и скорость окисления начинает возрастать.
Другая характерная особенность газофазного окисления углеводородов в области сравнительно невысоких давлений (0, 03–0, 25 МПа) и температур (200–400º С) связана с появлением так называемых холодных пламен. Они проявляются в виде бледно-голубого свечения, возникновение которого связано с взрывным разложением пероксидов, накапливающихся в окисляемом углеводороде, и с образованием боль-шого количества возбужденных молекул формальдегида (HCHO*). Вероятны реакции, образования которых идет по схемам:
Č Н3 + HOO  → HCHO* + Н2О
→ HCHO* + Н2О
RCH2O  + Ř ' → HCHO* + RR'
+ Ř ' → HCHO* + RR'
RCH2O  +
+  ОН → HCHO* + RОН
ОН → HCHO* + RОН
Появление холодных пламен сопровождается сравнительно небольшими изменениями в кинетике окисления углеводорода, наблюдается небольшое кратковременное повышение давления, а температура пламени обычно на 100–150º С выше температуры окружающей среды. Температура, при которой появляются холодные пламена, несколько понижается с увеличением молекулярной массы углеводорода и возрастает при переходе от парафиновых углеводородов к олефинам и нафтенам. При окислении ароматических углеводородов образование холодных пламен не наблюдается, нет их и при окислении метанола и формальдегида. Излучение холодных пламен обусловлено флуоресценцией формальдегида при переходе его возбужденных молекул (HCHO*) в основное состояние. В реакциях окисления углеводородов хемилюминесценция обусловлена реакциями рекомбинации различных свободных радикалов, в том числе пероксидных, образующихся при распаде молекулы инициатора-гидропероксида, азоизобутиронитрила, дициклогексилпероксидикарбоната и других. Хемилюминесценция является общим свойством свободных радикалов (соединений, имеющих некомпенсированный запас химической энергии), проявляющимся при их рекомбинации. В результате рекомбинации образуется молекула М* в возбужденном состоянии по схеме
R(1) + R(2) → M* (3.5)
Энергия возбуждения молекулы М* может выделяться в виде излучения по схеме
М* → М + hν, (3.6)
либо расходоваться по реакциям, не связанным с излучением:
M* → A0 + Тепло (3.7)
химическая реакция
М*  Продукты (3.8)
Продукты (3.8)
Когда вероятность реакции (3.6) больше, чем для реакций (3.7) и (3.8), наблюдается хемилюминесценция.
3.5 Противоокислительная стабильность жидких
углеводородов
На основании представлений о механизме зарождения цепей в окисляющихся жидких углеводородах можно провести сравнительную теоретическую оценку их противоокислительной стабильности. Если предположить, что в рассматриваемой системе преобладает гомогенный механизм зарождения цепей и допустить, что в начальной стадии окисления скорость процесса определяется наиболее медленной элементарной реакцией – зарождения цепей, то активированный комплекс этой реакции можно рассматривать как сольватированный. В сольватированном комплексе энергия активации понижается на величину, равную энтальпии сольватации: 
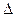 H = Uмакс.(n-1), где Uмакс. – максимальная энергия межмолекулярного взаимодействия между двумя молекулами; n – число молекул в осцилляторе.
H = Uмакс.(n-1), где Uмакс. – максимальная энергия межмолекулярного взаимодействия между двумя молекулами; n – число молекул в осцилляторе.
Если в отсутствие сольватации 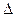 H
H 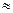 D0, где D0 – энергия диссоциации разрываемой связи, то для сольватированного активированного комплекса
D0, где D0 – энергия диссоциации разрываемой связи, то для сольватированного активированного комплекса 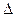 H = D0 – Uмакс.(n-1).
H = D0 – Uмакс.(n-1).
Энтропия изотермического процесса, в котором вследствие флуктуаций изменяется относительное расположение молекул в элементарной ячейке макротела, равна:
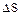 * = Uмакс./Т (3.9)
* = Uмакс./Т (3.9)
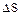 определяет наиболее благоприятные условия активации молекул и является энтропией активации реакции (0') зарождения цепей. Для расчета энергии активации используют уравнение константы скорости реакции:
определяет наиболее благоприятные условия активации молекул и является энтропией активации реакции (0') зарождения цепей. Для расчета энергии активации используют уравнение константы скорости реакции:
K = 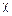 e
e 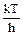 е(nUмакс.– D0)RT, (3.10)
е(nUмакс.– D0)RT, (3.10)
где 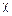 – трансмиссионный коэффициент характеризует вероятность сосредоточения энергии, переданной внутренним степеням свободы молекулы, на данном атоме и его можно представить в виде отношения
– трансмиссионный коэффициент характеризует вероятность сосредоточения энергии, переданной внутренним степеням свободы молекулы, на данном атоме и его можно представить в виде отношения
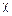 = С
= С 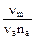 , (3.11)
, (3.11)
где 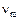 – частота колебаний кванта энергии, обмениваемой между молекулами;
– частота колебаний кванта энергии, обмениваемой между молекулами;
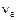 – частота деформационных колебаний атома, на котором сосредотачивается обмениваемая энергия;
– частота деформационных колебаний атома, на котором сосредотачивается обмениваемая энергия;
nа – число равноценных центров межмолекулярного взаимодействия с наибольшей электронной плотностью на внешних атомах;
С – опытная константа.
Следовательно, на основе рассмотренного механизма зарождения цепей можно оценивать противоокислительную стабильность углеводородов различного строения и объяснить некоторые особенности процесса их жидкофазного окисления. Как и в газофазном, при жидкофазном окислении наблюдается снижение величины коэффициента температурной зависимости в реакциях, когда зарождение цепей идет в основном по гомогенному механизму.
Энергия активации реакций (0') зарождения цепей является убывающей функцией с ростом Uмакс. и n. Это связано с тем, что число молекул в осцилляторе (n) меняет свое значение с изменением температуры, а соответственно изменению n с температурой будет меняться и энергия активации реакции (0') зарождения цепей. Следовательно, при жидкофазном окислении углеводородов, когда зарождение цепей идет преимущественно по гомогенному механизму, может существовать такая температура, при которой скорость реакции образования свободных радикалов будет наибольшей. Соответственно, при небольших временных превращениях, когда скорость цепного процесса определяется скоростью наиболее медленной стадии – зарождения цепей, скорость окисления также будет характеризоваться экстремальной температурной зависимостью.