
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные характеристики растворов электролитов
|
|
• Концентрация растворов. Способы выражения концентрации
Основной количественной характеристикой растворов является концентра-
ция, которая отражает содержание растворенного вещества в единице массы, единице объема раствора или растворителя. Наиболее часто употребляют сле-дующие способы выражения концентрации:
а) массовая доля ( ω ) — отношение массы растворенного вещества к общей массе раствора. Массовая доля растворенного вещества выражается в долях еди-ницы или в процентах:
| ω = | m(A) | (доли) или ω = | m(A) | ⋅ 100 (проценты), | (2.1) | |
| m(A) + m(B) | m(A) + m(B) | |||||
где m (А) и m (В) – масса растворенного вещества А и масса растворителя В.
Массовая доля растворенного вещества, выраженная в % – это масса раство-ренного вещества в 100 г раствора. Например, если известно, что используется 10%-ный раствор вещества А, то это означает, что в 100г такого раствора содер-жится 10г растворенного вещества;
б) молярная концентрация (См) — число молей растворенного вещества в 1 литре раствора:
| См = | m(A) | = | n | , моль/ л | (2.2) | |
| MV | V | |||||
где М — мольная масса растворенного вещества, г/моль; V — объем раствора, л; n = m(МА) — количество вещества, моль.

(!) Молярная концентрация раствора записывается следующим образом: См (НCl) = 0, 1 моль/л. Обозначение 0, 1 М НСl эквивалентно предыдущей записи.
При разбавлении раствора количество растворенного вещества остается од-ним и тем же, поэтому справедливо следующее соотношение:
| С1 | = | V2 | (2.3) | |
| С2 | ||||
| V1 |
где C1, V1 и С2, V2 — концентрация и объем раствора до и после разбавления соответственно;
в) нормальная концентрация или нормальность (Cн) — число эквивален-
тов растворенного вещества в 1 литре раствора:
| Сн = | m(А) | = | nэ | , мольэквивалентов/ л, | (2.4) | |
| Эвещ ⋅ V | ||||||
| V |
где Эвещ — эквивалентная масса растворенного вещества, г/моль;
nэ = m(A)/ Эвещ —количество вещества эквивалента или число эк-вивалентов, моль.
Эквивалент элемента(Э) —такое его количество, которое соединяется с1моль атомов водорода или 1/2 моль атомов кислорода в химических реакциях. Эквивалент выражается в молях.
Эквивалентная масса (Эвещ) —масса одного эквивалента вещества, выра-женная в граммах.
Эквивалент водорода равен одному молю атомов водорода, а эквива-лентная масса водорода равна 1 г/моль.
Эквивалент кислорода равен1/2моля атомов кислорода, а эквивалент-ная масса кислорода равна 8 г/моль.
Эквивалентный объем (VЭ)—объем, занимаемый при нормальных ус-
ловиях 1 эквивалентом газообразного вещества.
Для вычисления эквивалентного объема газов необходимо знать число эк-вивалентов в одном моле газа. Например, для водорода ЭH2 =1 г/моль, что в два
раза меньше массы моля, следовательно, объем эквивалента водорода в два раза меньше объема моля, т.е. VЭ(H 2 ) = 22, 4: 2 =11, 2 л. Аналогично
ЭO 2 = 1 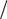 4 MO2 = 32: 4 =8 г/моль, отсюда эквивалентный объем кислорода в че-тыре раза меньше его молярного объема, т.е. VЭ(O 2 ) = 22, 4: 4 = 5, 6 л.
4 MO2 = 32: 4 =8 г/моль, отсюда эквивалентный объем кислорода в че-тыре раза меньше его молярного объема, т.е. VЭ(O 2 ) = 22, 4: 4 = 5, 6 л.
В качестве исходных величин при определении химических эквивалентов веществ приняты эквивалент водорода и эквивалент кислорода, поэтому необ-
ходимо помнить:
| Э(H2) = 1 мольатомов, | Э(O2) =1/ 2 моляатомов, | |||
| ЭH2 | = 1 г /моль, | ЭО2 = | 8 г/моль, | |
| V | = 11, 2 л/моль, | V | = 5, 6 л/моль. | |
| Э(Н2) | Э(O 2) |