
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения типовых задач. Задача1.Вычислить концентрацию ионов К+иSO42-в0,05М растворе суль-фата калия К2SO4.
|
|
Задача1. Вычислить концентрацию ионов К+иSO42-в0, 05М растворе суль-фата калия К2SO4.
Решение. Записываем процесс электролитической диссоциации, за счет ко-торого в растворе появляются ионы:
К2SO4 → 2К+ + SO42-
n=2 n=1
Отмечаем, что К2SO4 – сильный электролит, его истинная степень диссоциа-ции равна 1. Согласно уравнению диссоциации, из 1 моля К2SO4 образуется 2 моля ионов К+ и 1 моль ионов SO42-. Из уравнения (2.11) находим
C K + = n α Cм(К2SO4) = 2 ⋅ 1 ⋅ 0, 05 = 0, 1 моль/л; CSO24- = n α Cм(К2SO4) = 1 ⋅ 1 ⋅ 0, 05 = 0, 05 моль/л.
Задача2. Определить концентрацию ионов водорода в0, 01М растворе хлор-новатистой кислоты HClO.
Решение. В растворе в результате электролитической диссоциации кислотыустанавливается равновесие
слабый электролит используем таблицу 1 приложения
HClO H+ + ClО– КД = 5, 0·10–8;
n=1 n=1
H2O H+ + OH– KH2O = 10–14.
Оба электролита слабые, но из сравнения констант следует, что основной процесс, определяющий концентрацию ионов водорода в растворе, – диссоциа-ция самой кислоты, поэтому, решая задачу, будем учитывать только диссоциа-
цию кислоты (в дальнейшем будем поступать аналогично).
Концентрация ионов водорода зависит от концентрации раствора и степени диссоциации: CH+ = n · α · Cм(HClO). Так как при диссоциации HClO образуется один ион водорода, то n = 1. Степень диссоциации слабого электролита (при ус-ловии α < < 1) определяется соотношением (2.4):
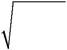
| 5 ⋅ 10− 8 | = | 5, 0 ⋅ 10 | − 6 | = 2, 24 ⋅ 10 | − 3 | |||
| α = Kд /CМ | = | . | ||||||
| 10-2 | ||||||||

 Теперь можно рассчитать концентрацию ионов водорода: CH+ = 1 · 2, 24·10-3 · 0, 01 = 2, 24·10-5 моль/л.
Теперь можно рассчитать концентрацию ионов водорода: CH+ = 1 · 2, 24·10-3 · 0, 01 = 2, 24·10-5 моль/л.
2-й вариант решения задачи.
Для расчета CH+ можно сразу использовать выражение (2.16) CH+ = n  KД ⋅ CM = 5 ⋅ 10 − 8 ⋅ 0, 01 =2, 24·10-5 моль/л.
KД ⋅ CM = 5 ⋅ 10 − 8 ⋅ 0, 01 =2, 24·10-5 моль/л.
Задача3. Вычислить рН раствора гидроксида калия, полученного при рас-творении 0, 56г КОH в 1 л воды.
Решение. Запишем уравнение диссоциации щелочи
KOH → K+ + OH– (сильный, α = 1).
Из уравнения диссоциации видно, что для расчета рН вначале следует рас-считать концентрацию в растворе OH––ионов, а затем воспользоваться соотно-шением ионного произведения воды (2.18) для расчета концентрации в растворе ионов водорода.
Для определения концентрации ионов OH– необходимо знать молярную кон-центрацию раствора КОH. Считаем, что объем раствора при внесении 0, 56г ще-лочи в 1 л воды не меняется:
| CM(КOH) = | m(KOH) | = | 0, 56 | = 0, 01моль/л. | |
| M(KOH) ⋅ V | 56 ⋅ 1 | ||||
Тогда, используя соотношение (2.11), рассчитаем концентрацию OH- в рас-
творе СOH- = n · α · Cм(КОH) = 1 · 1 · 0, 01 = 0, 01 моль/л.
Исходя из ионного произведения воды KH2O, находим концентрацию ионов H+:
CH+ = KH2O/ COH- = 10-14/10-2 = 10-12 моль/л.
Водородный показатель раствора КОН равен
pH = – lg CH+ = – lg 10-12 = 12.
Й вариант решения задачи.
Определив концентрацию ионов OH– в растворе, найдем pOH, а затем вос-пользуемся соотношением рH + pOH = 14 для расчета рН раствора.
pOH = – lg COH- = – lg 10-2 = 2. Откуда рH = 14 – pOH = 14 – 2 = 12.
Задача4. Во сколько раз уменьшится концентрация ионов водорода(CH+)в0, 2 M
растворе муравьиной кислоты HCOOH (Kд = 1, 8 · 10-4), если к 1 л этого раствора доба-вить 0, 1 моль соли HCOONa, считая, что эта соль диссоциирует полностью (α =1)?
Решение. Запишем уравнение диссоциации кислоты
| HCOOH | H + + HCOO− | ||||||
| Определяем исходную концентрацию ионов водорода CH+. | |||||||
| C | + = n | K | С | М | = 1, 8⋅ 104 | ⋅ 2 ⋅ 10− 1 = 6 ⋅ 10− 3 моль/ л (n =1). | |
| H | д |
 2. Определяем концентрацию Н+ после добавления соли НСООNa. Диссо-циация соли НСООNa выражается уравнением HCOONa Na + + HCOO− . Концентрацию Н+ после добавления соли НСООNa обозначим через х. Тогда концентрация недиссоциированных молекул кислоты будет равна (0, 2– x). Кон-центрация ионов НСОО- будет складываться из двух величин: из концентрации ионов за счет диссоциации кислоты, равной концентрации ионов водорода, т.е. CHCOO − = C H+ = x; и концентрации, обусловленной присутствием в растворе соли
2. Определяем концентрацию Н+ после добавления соли НСООNa. Диссо-циация соли НСООNa выражается уравнением HCOONa Na + + HCOO− . Концентрацию Н+ после добавления соли НСООNa обозначим через х. Тогда концентрация недиссоциированных молекул кислоты будет равна (0, 2– x). Кон-центрация ионов НСОО- будет складываться из двух величин: из концентрации ионов за счет диссоциации кислоты, равной концентрации ионов водорода, т.е. CHCOO − = C H+ = x; и концентрации, обусловленной присутствием в растворе соли
и равной 0, 1. Таким образом, общая концентрация ионов HCOO− равна (0, 1+ х). Исходя из уравнения (2.2), запишем:
| K д = | C H + CHCOO− | = | x(0, 1 + x) | =1, 8 ⋅ 10− 4. | |
| C HCOOH | 0, 2 − x | ||||
Поскольку в присутствии одноименных ионов НСОО- диссоциация му-равьиной кислоты очень мала, то значением х по сравнению с 0, 1 и 0, 2 можно пренебречь, отсюда
| 1, 8 ⋅ 10− 4 = | 0, 1x | x = 3, 6 ⋅ 10 − 4 ì î ë ü / ë. |
| 0, 2 |
3. Определяем соотношение концентрации ионов водорода.
Сравнив исходную концентрацию CH+ (6 · 10-3) с рассчитанной после добав-ления соли НСООNa (3, 6 · 10-4), находим, что CH+ уменьшилась в 16, 7 раза.
Задача5. Вычислить рH 0, 49%-ного раствора(ρ = 1г/мл)ортофосфорнойкислоты, учитывая только 1-ю ступень диссоциации.
Решение. Для определения величины рHраствора необходимо рассчи-тать концентрацию ионов водорода. Записываем уравнение диссоциации ки-слоты по первой ступени:
| H 3 PO 4 | H + + H 2 PO 4 | − (K Д = 7, 5 ⋅ 10 − 3) |
Для определения концентрации ионов водорода необходимо знать молярную концентрацию раствора H 3 PO4. Масса 1 л раствора H 3 PO4 с учетом указанной в
условии задачи плотности равна 1000 г. Определим массу кислоты в 1 л раствора
mH 3 PO4 = ω ⋅ mp-pa = 0, 0049 ⋅ 1000 = 4, 9г.
Молярная концентрация раствора составит
| C | M(H 3 PO 4) | = | m(H3 PO4) | = | 4, 9 | = 0, 05 моль/л. | ||||
| M(H3 PO4)V 98⋅ 1 | ||||||||||
| Для расчета CH+ используем выражение (2.16) | ||||||||||
| C | H | + = n K | Д | C | M | = 7, 5⋅ 10− 3 ⋅ 0, 05 = 1, 9 ⋅ 10-2 | моль/л. | |||

pH = – lg CH+ = – lg 1, 9·10-2 = 1, 72.
Задача6. Рассчитайте, как изменится рH 0, 005М раствораNH4OHпри раз-бавлении его в 10 раз.
Решение. NH4OH –слабое основание(КД=1, 8·10-5), диссоциирует обратимо:
NH4 OH ← → NH+4 + OH− . Из уравнения диссоциации видно, что для расчета рН
вначале следует рассчитать концентрацию в растворе OH− – ионов, а затем вос-пользоваться соотношением рH = 14 – pOH.
Найдем сначала рH 0, 005 М раствора NH4OH:
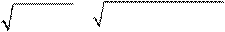 α = α =
| K | Д | / С | M | = 1, 8 ⋅ 10 − 5 | /5 ⋅ 10 − 3 | = 6 ⋅ 10 − 2; | ||||||||||||||
| C | OH | − = α C | = 6 ⋅ 10 − 2 ⋅ 5 ⋅ 10 − 3 = 3 ⋅ 10− 4 моль/л; | ||||||||||||||||||
| M1 | |||||||||||||||||||||
| pOH = – lg COH− = – lg 3·10-4 = 3, 52. | Откуда рH =14 –3, 52 = 10, 48. | ||||||||||||||||||||
| Теперь рассчитаем | рH | раствора, | разбавленного в 10 раз, | ||||||||||||||||||
| CM2 = 0, 00005 моль/л: | |||||||||||||||||||||
| α | = | K | Д | / С | = 1, 8 ⋅ 10− 5 /5 ⋅ 10− 4 = 0, 19; | ||||||||||||||||
| M2 | |||||||||||||||||||||
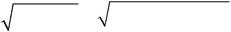 C OH− = α 2 ⋅ C M2 = 1, 9 ⋅ 10 − 1 ⋅ 5 ⋅ 10 − 4 = 9, 5 ⋅ 10− 5 моль/л;
C OH− = α 2 ⋅ C M2 = 1, 9 ⋅ 10 − 1 ⋅ 5 ⋅ 10 − 4 = 9, 5 ⋅ 10− 5 моль/л;
pOH = – lg СOH- = – lg 9, 5·10-5 = 4, 0. Откуда рH =14 – 4, 0 = 10. Итак, вслед-
ствие разбавления раствора рH уменьшилось с 10, 48 до 10.