Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакции элиминирования
|
|
Реакции элиминирования сопровождаются отщеплением галоге-новодорода от галогеналкана и приводят к образованию алкенов.
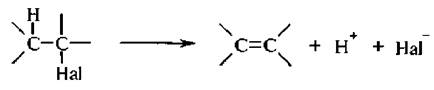
Поскольку отщепление водорода происходит от β -атома углерода, то такие реакции называются β - или 1.2-элиминированием.
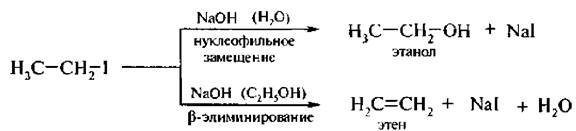
Реакции элиминирования (Е) и нуклеофильного замещения (SN2) конкурируют друг с другом, но в определенных условиях каждая из них может стать доминирующей. Отщепление галогеноводорода от галогеналкана становится основным процессом в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов или алкоголяты щелочных металлов. Элиминированию способствуют также повышение температуры реакционной смеси и концентрации реагентов. Так, при взаимодействии йодэтана с водным раствором щелочи основным направлением реакции является нуклеофильное замещение, а продуктом реакции – этиловый спирт. При использовании спиртового раствора щелочи доминирующим процессом становится реакция элиминирования, продуктом реакции – этилен.
Реакции элиминирования галогеналкаиов могут протекать по мономолекулярному (E1) и бимолекулярному (Е2) механизмам.
Механизм Е2 (бимолекулярное элиминирование).
В реакции отщепления по механизму Е2 наиболее легко вступают первичные галогеналканы.
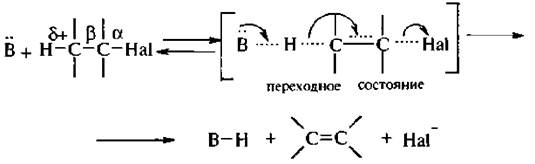
Реакция отщепления, протекающая по бимолекулярному механизму, требует присутствия основания, идет волну стадию с образованием переходного состояния, в формировании которого принимаютучастие молекулы двух реагентов. И поэтому скорость такой реакции зависит от концентрации обоих реагентов. Процессы разрыва и образования связей в переходном состоянии происходят синхронно,
В отличие от механизма SN2 в механизме Е2 частица с неподеленной парой электронов или несущая отрицательный заряд действует не как нуклеофил, а как основание, атакуя атом водорода при β -углеродном атоме.
Механизм E1 (мономолекулярное элиминирование).
Наиболее легко происходит элиминирование поданному механизму у третичных галогеналканов. Реакция не требует основания как реагента, но для ее протекания необходим ионизирующий растворитель. Процесс является двустадийным.
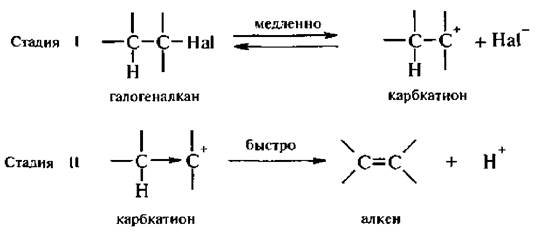
Стадией, определяющей скорость реакции, является образование карбкатиона. Вторая стадия включает в себя стабилизацию карбкатиона путем отщепления протона.
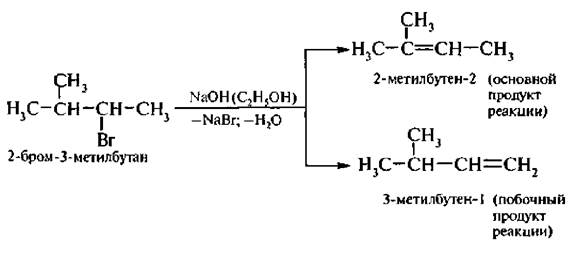
Если в молекуле галогеналкана имеется несколько альтернативных путей отщепления галогеноводорода, то реализуется тот из них, при котором двойная связь образуется у наиболее замешенного атома углерода, то есть вместе с галогеном уходит водород от наименее гидрогенизированного соседнего атома углерода.
Эта закономерность получила название правила Зайцева;
Взаимодействие с металлами
При взаимодействии галогеналканов с такими металлами, как магний, образуются магнийорганические соединения – реактивы Гриньяра:

Магнийорганические соединения являются сильными нуклеофильными реагентами и сильными основаниями. Их активность обусловлена полярностью связи углерод-магний:
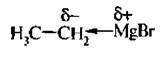
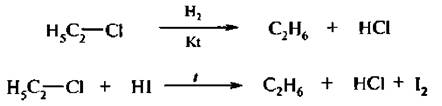
Восстановление галогеналканов
При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также йодоводородной кислотой происходит замещение атома галогена водородом: