
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Свойства ковалентной связи
|
|
Длина связи – это межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина.
Энергия связи – определяется количеством энергии, которое необходимо для разрыва связи.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей.
Например: Н – неспаренный ℮ - 1 связь Н — Н;


С* - 4 неспаренных ℮ - 4 связи Н - С – Н;

Направленность – обусловливает пространственную структуру молекул, т.е. их геометрию (форму). Рассмотрим это на примере образования молекул Н2О (рис.) и NH3 (рис.5.)
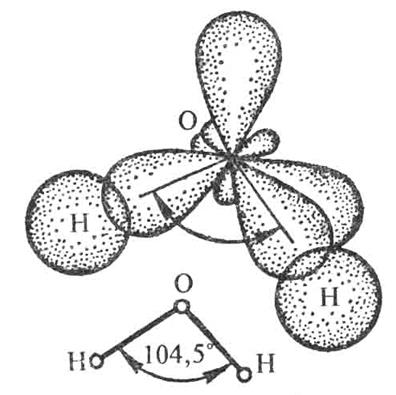
.Рис.4. Схема образования химических связей в молекуле H2O
Форма молекулы воды – угловая.
О+7 1s22s22p4 – 2 неподеленные пары, 2 неспаренных электрона.
Ð НОН = 104, 5°.

Рис. 5. Схема образования химических связей в молекуле NH3
Форма молекулы аммиака – пирамидальная.
N+7 1s2 2s2 2p3 – 3 неспаренных электрона.
Ð НОН = 107, 3°. Углы между связями называются валентными.