
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гибридизация атомных орбиталей
|
|
p p










 BeCl2.
BeCl2.

 s s
s s
n=2 px py pz E px py pz
s s
 |
n=1
y Be 1s22s1 y Be* 1s22s12p1
....
: Cl: Be: Cl:
....
Обе связи Be-Cl одинаково прочны и расположены под углом 180°.
Одинаковая прочность связей объясняется гибридизацией валентных орбиталей, т.е. смещением их и выравниванием по форме и энергии (рис.6.)

Рис.6. Форма sp-гибридной орбитали
Гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа (к примеру, s- и р – электроны) (рис.7.) При этом число гибридных орбиталей равно числу исходных (рис.8.).
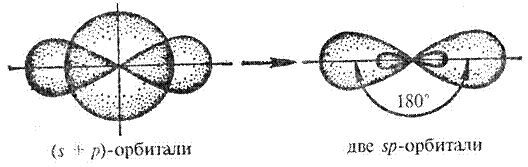
Рис.7. sp-гибридизация валентных орбиталей
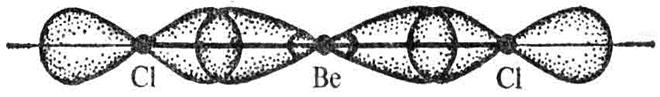
Рис. 8. Линейная молекула BeCl2
BCl3.
Е
B – 1s22s22p1 ® B* - 1s22s12p2 (рис.9)
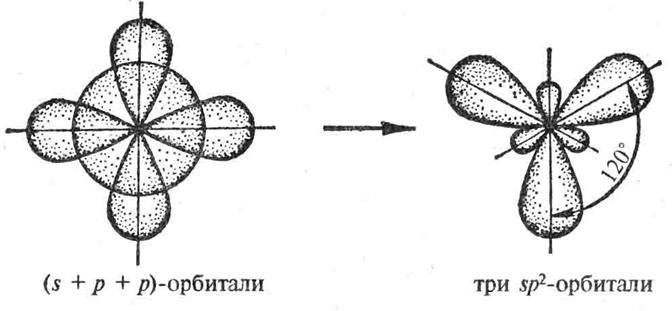
Рис. 9. sp2-гибридизация валентных орбиталей
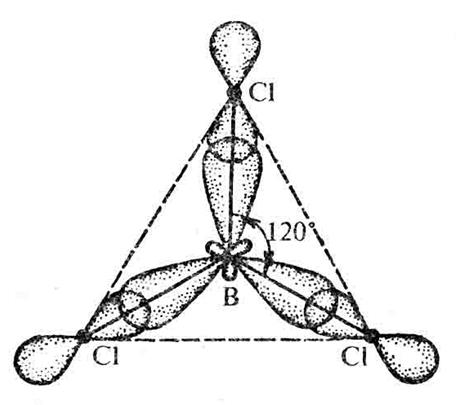 Молекула BCl3 имеет форму плоского равностороннего треугольника с атомом В в центре (рис.10)
Молекула BCl3 имеет форму плоского равностороннего треугольника с атомом В в центре (рис.10)
Рис.10. Плоская треугольная молекула BCl3
СН4. p p

 s s
s s
E
 n=2 px py pz px py pz
n=2 px py pz px py pz
s s
n=1
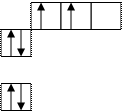
6C 1s22s22p1x2py1 6C* 1s22s12px12py12pz1 (рис.11.)
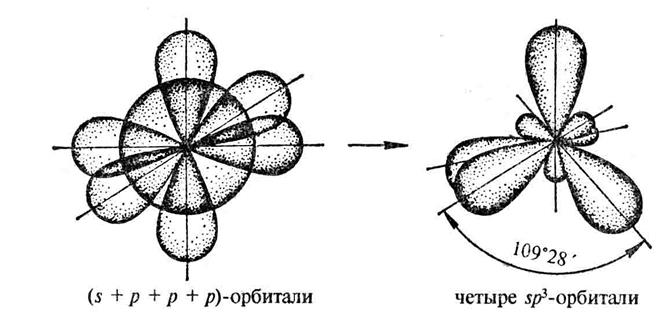
Рис. 11. sp3-гибридизация валентных орбиталей
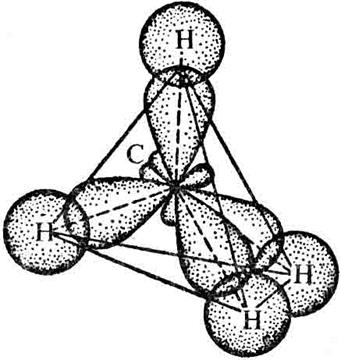
Рис. 12. Схема образования химических связей в тетраэдрической молекуле метана
Молекула СН4 имеет форму правильного тетраэдра (рис.12.)
Ионная связь – химическая связь между ионами, осуществляемая электростатическим притяжением.
Na 1s22s22p63p1 .
Cl 1s22s22p63s23p5 .
Na - ℮ = Na+
Cl + ℮ = Cl-
Na+ 1s22s22p6 (оболочка атома Ne).
Cl- 1s22s22p63s23p6 (оболочка атома Ar).