
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
От активностей компонентов, участвующих в реакции
|
|
Рассмотрим гальванический элемент, в котором при постоянном давлении и температуре протекает окислительно-восстановительная реакция
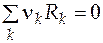 .
.
Реакция протекает самопроизвольно за счет убыли энергии Гиббса, причем справедливо соотношение
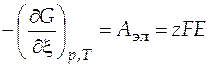 , (8)
, (8)
где 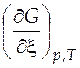 - дифференциальное мольное изменение энергии Гиббса за счет протекания химической реакции;
- дифференциальное мольное изменение энергии Гиббса за счет протекания химической реакции;
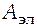 - электрическая работа;
- электрическая работа;
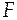 - число Фарадея, равное 96485 Кл/моль;
- число Фарадея, равное 96485 Кл/моль;
Е - электродвижущая сила гальванического элемента;
z - число электронов, участвующих в электродной реакции, протекающей в гальваническом элементе.
Таким образом, для обратимого элемента его ЭДС может служить мерой изменения энергии Гиббса реакции, совершающейся в элементе.
Запишем уравнение изотермы реакции Вант-Гоффа для данной реакции
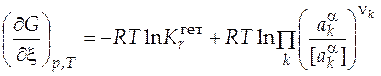 , (9)
, (9)
где 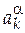 - произвольно заданные активности компонентов в фазе α;
- произвольно заданные активности компонентов в фазе α;
[ 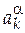 ]− размерность активности компонента в фазе α;
]− размерность активности компонента в фазе α;
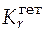 - константа равновесия гетерогенной реакции.
- константа равновесия гетерогенной реакции.
Уравнение (9) можно также записать в виде:
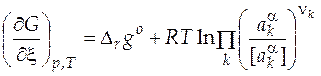 .
.
Активности компонентов, находящихся в разных фазах, выражаются в разных концентрационных шкалах:
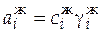 [ a ж] = [ с ж] = моль/л;
[ a ж] = [ с ж] = моль/л;
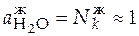 ;
; 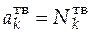 для чистых веществ
для чистых веществ 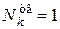 ;
;
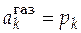 [ рk ] = 1 атм.
[ рk ] = 1 атм.
Теперь можно выразить ЭДС элемента с учетом активностей компонентов реакции
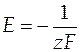
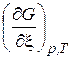 =
= 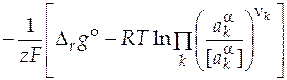 . (10)
. (10)
Если активности компонентов равны единице, то получим стандартную ЭДС гальванического элемента (зависящую от природы электродов и температуры)
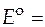
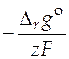 , (11)
, (11)
с учетом которой уравнение (9) можно представить в виде
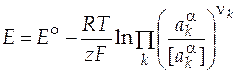 . (12)
. (12)
Уравнение (12) называют уравнением Нернста. Далее для простоты условно опустим из записи уравнений обозначение размерностей, понимая, что всякий раз под логарифмом стоит безразмерная величина.
Для рассмотренного выше элемента Даниэля-Якоби уравнение (12) запишется так:
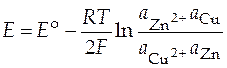 .
.
Активности чистых металлов (меди и цинка) в N -шкале равны 1, поэтому
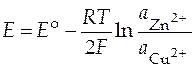 .
.
По источнику электродвижущей силы гальванические элементы делятся на химические и концентрационные.
В химических гальванических элементах источником ЭДС является химическая реакция. В концентрационных элементах ЭДС возникает за счет разной концентрации ионов в растворах и вещества на электродах.
И химические, и концентрационные ГЭ по наличию или отсутствию диффузионной разности потенциалов (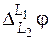 ) делятся на элементы с переносом и элементы без переноса.
) делятся на элементы с переносом и элементы без переноса.
В данной курсовой работе будут исследоваться только химические гальванические элементы без переноса.
Рассмотрим подробнее, как правильно составить схему гальванического элемента без переноса на основе данных задания к курсовой работе.
Например, требуется составить схему гальванического элемента без переноса из двух электродов:
первый электрод
Cl− | AgClтв, Ag
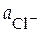 = 1 моль/л = 1 моль/л
| второй электрод
H+| H2, Pt
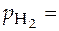 1 атм; 1 атм; 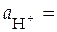 1 моль/л 1 моль/л
|
Слева в схеме ГЭ должен располагаться электрод, обладающий более отрицательным электродным потенциалом, а справа − более положительным. Логично поэтому сравнить стандартные электродные потенциалы указанных электродов и выяснить, какой электрод, в какой части гальванического элемента будет расположен. Электродные потенциалы в таблицах сгруппированы по типам электродов, поэтому, необходимо определить, к каким типам эти электроды относятся. Очевидно, что первый из указанных электродов − это электрод второго рода (хлорсеребряный электрод), а второй электрод − это газовый (водородный) электрод.
Выпишем из справочника электродные реакции и значения стандартных электродных потенциалов
Электрод Реакция 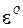
Cl− | AgClтв, Ag 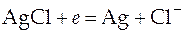 0, 222 В
0, 222 В
H+| H2, Pt H++ e → ½ H2 0, 0 В
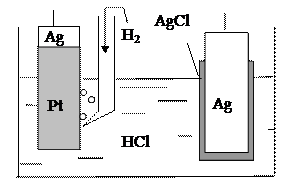 Судя по значению стандартных электродных потенциалов, слева будет расположен водородный электрод, справа − хлорсеребряный (рис.4). Поскольку по заданию гальванический элемент должен быть без переноса, то электролитом будет такой раствор, в котором катион совпадает с катионом водородного электрода, а анион- с анионом хлорсеребряного электрода. Таким раствором может быть только раствор хлористого водорода.
Судя по значению стандартных электродных потенциалов, слева будет расположен водородный электрод, справа − хлорсеребряный (рис.4). Поскольку по заданию гальванический элемент должен быть без переноса, то электролитом будет такой раствор, в котором катион совпадает с катионом водородного электрода, а анион- с анионом хлорсеребряного электрода. Таким раствором может быть только раствор хлористого водорода.
Рис. 4
Запишем схему гальванического элемента
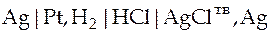 .
.
На концах данного гальванического элемента расположен один и тот же металл, т.е. это правильно разомкнутый гальванический элемент.
При записи реакции на электродах необходимо помнить, что катодная реакция пишется также, как она приведена в справочнике, а анодная реакция пишется, как реакции окисления, т.е. формально берется реакция из справочника и меняются местами правая и левая части уравнения.
Катодная реакция: 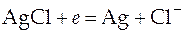
Анодная реакция: 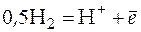
Итоговая реакция:
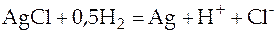 . (13)
. (13)
Используем формулу (12) для выражения зависимости электродвижущей силы этого гальванического элемента от концентрации электролита.
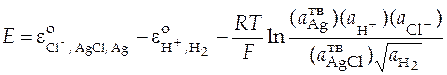 .
.
Активности чистого серебра и чистого хлористого серебра в N -шкале равны 1, активность газообразного водорода выражается в р -шкале, т.е. уравнение принимает вид:
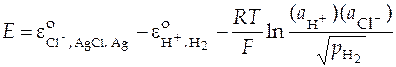 .
.
При переходе от активности к концентрациям (при р = 1 атм) получаем
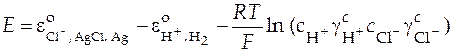 ,
,
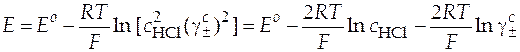 , (14)
, (14)
где 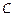 − концентрация раствора электролита, моль/л;
− концентрация раствора электролита, моль/л;
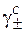 − средний ионный коэффициент активности раствора электролита, выраженный в с -шкале.
− средний ионный коэффициент активности раствора электролита, выраженный в с -шкале.
Рассмотрим еще один пример. Пусть нужно составить ГЭ из таких электродов:
первый электрод
Сu2+ | Cu
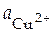 = 1 моль/л = 1 моль/л
| второй электрод
Cl− | PbCl2тв, Pb
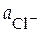 = 1 моль/л = 1 моль/л
|
Первый электрод относится к электродам первого рода, второй электрод − к электродам второго рода.
Выписываем из справочника реакции и значения стандартных электродных потенциалов.
Электрод Реакция 
Сu2+ | CuCu2++ 2 e → Cu+0, 337 В
Cl− | PbCl2тв, Pb PbCl2 + 2 e → Pb + 2Cl− − 0, 268 В
Судя по значению стандартных электродных потенциалов слева в нашем ГЭ будет расположен хлорсвинцовый электрод, а справа медный электрод. Электролитом нашего ГЭ без переноса должен быть раствор, в котором катион такой же как в электроде первого рода, а анион− такой же как анион в электроде второго рода, т.е. электролитом может быть только раствор хлорида двухвалентной меди (рис.5), а схема правильно разомкнутого ГЭ будет такой:
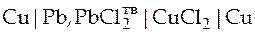
Электродные реакции
Катодная реакция: 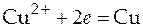
Анодная реакция: 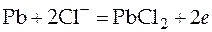
Итоговая реакция: 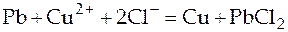 (15)
(15)
Уравнение Нернста для ЭДС данного гальванического элемента.
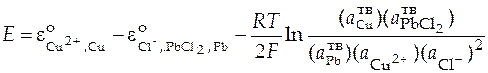 .
.
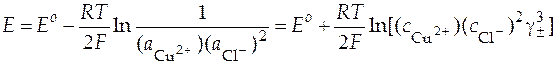 .
.
В соответствии с уравнением диссоциации соли CuCl2 при концентрации хлорида меди равной c, концентрации ионов будут следующими: 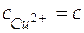 ;
; 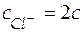 . С учетом этого получим уравнение Нернста:
. С учетом этого получим уравнение Нернста:
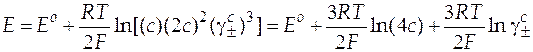 . (16)
. (16)
Конечно, уравнения для расчета ЭДС будут различными в зависимости от природы электродов, составляющих гальванический элемент, и числа электронов, участвующих в итоговой реакции. Не останавливаясь на выводе этих уравнений, приведем их кратко в табл.1.
Таблица 1