
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергии Гиббса, энтропии и энтальпии реакции
|
|
| Вещество |  кДж/моль
кДж/моль
| 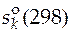 Дж/(моль∙ К)
Дж/(моль∙ К)
|  кДж/моль
кДж/моль
|
| Agтв | 42, 55 | ||
| AgClтв | − 126, 78 | 96, 23 | − 109, 84 |
| H2 | 130, 52 | ||
| H+ aq | |||
| Cl− aq | − 167, 07 | 56, 74 | − 131, 29 |
Стандартную мольную энтропию реакции находят по формуле
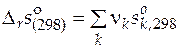 ,
,
где 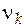 − стехиометрическое число вещества в данной реакции;
− стехиометрическое число вещества в данной реакции;
 − стандартная мольная энтропия вещества k при 298 К.
− стандартная мольная энтропия вещества k при 298 К.
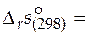 (− 1)∙ 96, 23+(− 0, 5)∙ 130, 52+1∙ 0+1∙ 56, 74+1∙ 42, 55 =
(− 1)∙ 96, 23+(− 0, 5)∙ 130, 52+1∙ 0+1∙ 56, 74+1∙ 42, 55 =
= − 62, 2 Дж/(моль∙ К)
Для расчета стандартной мольной энтальпии итоговой реакции используют формулу

где 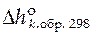 − стандартная мольная энтальпия образования чистого вещества k из простых веществ при 298 К.
− стандартная мольная энтальпия образования чистого вещества k из простых веществ при 298 К.
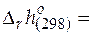 (− 1)∙ (− 126, 78)+(− 0, 5)∙ 0+1∙ 0+1∙ 0+1∙ (− 167, 07) =
(− 1)∙ (− 126, 78)+(− 0, 5)∙ 0+1∙ 0+1∙ 0+1∙ (− 167, 07) =
= − 40, 29 кДж/моль.
Расчет стандартной мольной энергии Гиббса итоговой реакции можно найти по формуле:
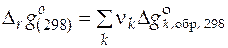 ,
,
где 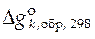 − стандартная мольная энергия Гиббса образования чистого вещества k из простых веществ при 298 К.
− стандартная мольная энергия Гиббса образования чистого вещества k из простых веществ при 298 К.
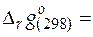 (− 1)∙ (− 109, 84)+(− 0, 5)∙ 0+1∙ 0+1∙ 0+1∙ (− 131, 29) =
(− 1)∙ (− 109, 84)+(− 0, 5)∙ 0+1∙ 0+1∙ 0+1∙ (− 131, 29) =
= − 21, 45 кДж/моль.
Сопоставление результатов, полученных методом ЭДС и расчетом по таблицам термодинамических величин показывает удовлетворительное совпадение при расчете стандартных мольных энтропии, энтальпии и энергии Гиббса реакции.
Имеет смысл остановиться более подробно на соотношении между термодинамическими функциями, характеризующими токообразующую реакцию в гальваническом элементе. Этот материал подробно рассмотрен в [7].
Применим к гальваническому элементу при постоянном давлении уравнение Гиббса-Гельмгольца в виде:
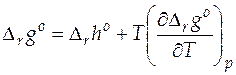 . (21)
. (21)
Токообразующая реакция является итогом электродных процессов и соответствует прохождению через гальванический элемент z электронов. Из уравнения (21) и (17) получаем
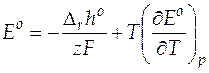 . (22)
. (22)
Так как 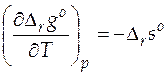 , то
, то 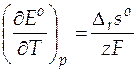 .
.
Температурный коэффициент ЭДС характеризует изменение энтропии в ходе соответствующей химической реакции. Известно, что произведение 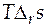 будет определять тепловой эффект при обратимом протекании реакции в гальваническом элементе, т.е. он равен
будет определять тепловой эффект при обратимом протекании реакции в гальваническом элементе, т.е. он равен
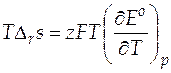 . (23)
. (23)
А величина 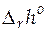 характеризует тепловой эффект химической реакции при ее необратимом протекании в условиях постоянного давления.
характеризует тепловой эффект химической реакции при ее необратимом протекании в условиях постоянного давления.
Поскольку мы рассматриваем гальванический элемент, то химическая реакция в нем протекает самопроизвольно, т.е. E > 0.
Из анализа уравнения (22) следует, что при отрицательном температурном коэффициенте ЭДС 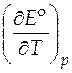 < 0 реакция, протекающая в ГЭ, может быть только экзотермической (
< 0 реакция, протекающая в ГЭ, может быть только экзотермической (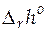 < 0). Поскольку при ее протекании энтропия уменьшается (
< 0). Поскольку при ее протекании энтропия уменьшается ( < 0), то работа гальванического элемента должны сопровождаться выделением теплоты. В условиях теплоизоляции, такой гальванический элемент будет нагреваться.
< 0), то работа гальванического элемента должны сопровождаться выделением теплоты. В условиях теплоизоляции, такой гальванический элемент будет нагреваться.
Если 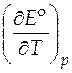 = 0, то реакция тоже только экзотермическая (
= 0, то реакция тоже только экзотермическая (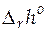 < 0), но при этом изменение энтропии равно нулю и работа ГЭ, совершаемая за счет убыли энтальпии не сопровождается тепловыми эффектами.
< 0), но при этом изменение энтропии равно нулю и работа ГЭ, совершаемая за счет убыли энтальпии не сопровождается тепловыми эффектами.
Если 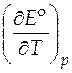 > 0, то протекающая в гальваническом элементе реакция сопровождается ростом энтропии, поэтому при работе такого элемента происходит поглощение теплоты из окружающей среды. Если гальванический элемент изолирован, то он охлаждается. Химическая реакция в ГЭ может быть как экзотермической так и эндотермической. Если
> 0, то протекающая в гальваническом элементе реакция сопровождается ростом энтропии, поэтому при работе такого элемента происходит поглощение теплоты из окружающей среды. Если гальванический элемент изолирован, то он охлаждается. Химическая реакция в ГЭ может быть как экзотермической так и эндотермической. Если 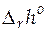 < 0, то электрическая работа совершается за счет убыли энтальпии и за счет энтропийного члена уравнения (22)
< 0, то электрическая работа совершается за счет убыли энтальпии и за счет энтропийного члена уравнения (22)  > 0. Если
> 0. Если 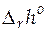 = 0, то электрическая работа совершается только за счет роста энтропии в системе. Обычный путь использования химической энергии реакции невозможен, т.к. тепловой эффект равен нулю. Если реакция эндотермическая
= 0, то электрическая работа совершается только за счет роста энтропии в системе. Обычный путь использования химической энергии реакции невозможен, т.к. тепловой эффект равен нулю. Если реакция эндотермическая
(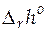 > 0), но
> 0), но  >
> 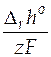 , то согласно уравнению (22) от гальванического элемента можно получить работу. В этих условиях за счет энтропийного фактора (т.е. за счет роста энтропии системы) не только совершается электрическая работа, но и увеличивается энтальпия системы.
, то согласно уравнению (22) от гальванического элемента можно получить работу. В этих условиях за счет энтропийного фактора (т.е. за счет роста энтропии системы) не только совершается электрическая работа, но и увеличивается энтальпия системы.