
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Правило фаз Гиббса
|
|
Правило фаз Гиббса выражает общие закономерности существования устойчивых фаз в условиях равновесия. Оно показывает, происходит ли процесс кристаллизации при постоянной температуре или в интервале температур, и указывает, какое число фаз может одновременно существовать в системе.
С = К + 1 – Ф
К – число компонентов (веществ, образующих систему)
Ф – число фаз
1- температура (внешний фактор). Диаграммы состояния обычно строят при постоянном (атмосферном) давлении
С – число степеней свободы, т.е. число независимых переменных внутренних (состав фаз) и внешних (tо) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии С≥ 0
Число фаз в сплаве, находящемся в равновесии, не может быть больше, чем число компонентов + 1. Если в равновесии находится максимальное число фаз, то С=0 (система нонвариантна), т.е. существование всех фаз возможно при постоянной температуре и определенном составе фаз (на кривой охлаждения имеется горизонтальный участок).
Кривые охлаждения и диаграмма состояния для сплавов, образующих при затвердевании механическую смесь.
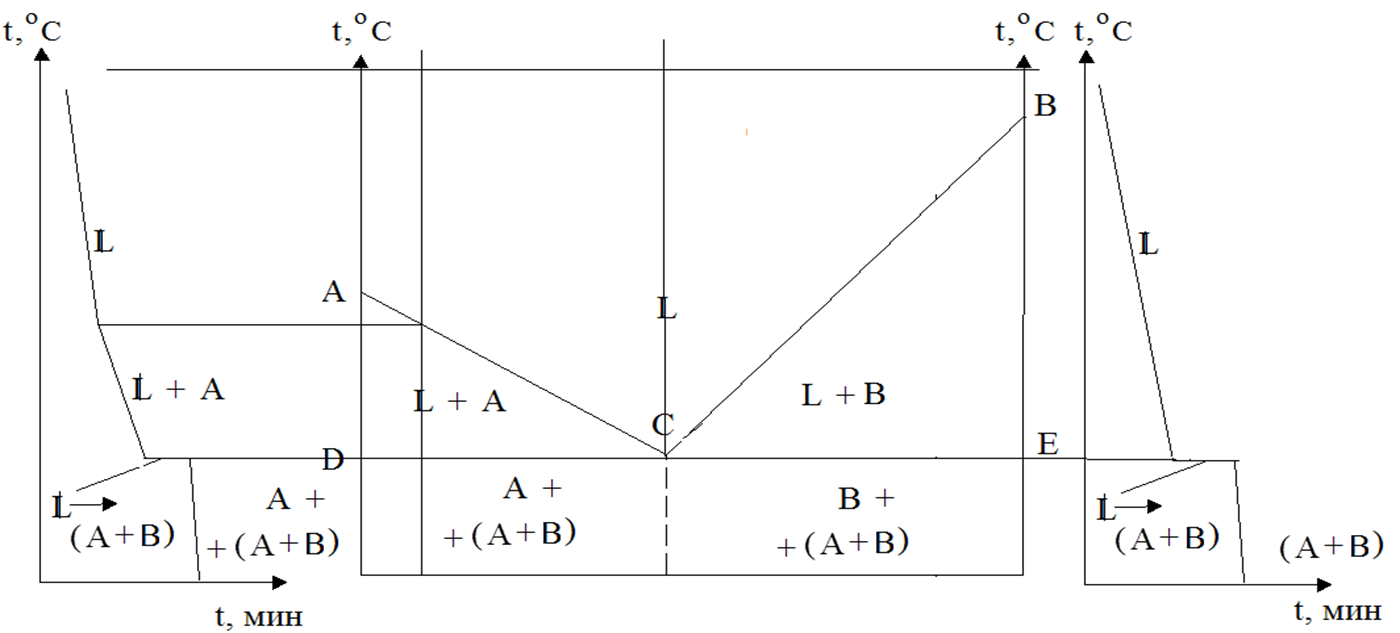
Компоненты: вещества А и В. Фазы: жидкий раствор L, кристаллы А и кристаллы В. Максимальное значение фаз – 3. АВС –линия «ликвидус». Выше нее система находится в жидком состоянии. DCE – линия «солидус». Ниже нее система находится в твердом состоянии. DCE – линия эвтектиктических превращений. Т. А и В – температуры плавления чистых веществ. Т.С – точка эвтектики. Эвтектика – механическая смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкости.