
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет 12
|
|
1) термодинамическая характеристика твердофазовых реакций: изменение энергии Гиббса и условия, при которых в процессе твердофазовой реакции возможно установление термодинамического равновесия.
Условие равновесия: Δ G = Δ H – TΔ S ≈ 0, где Δ H – теплота реакции; Δ S – изменение энтропии в ходе реакции; Т – температура.
Это условие реализуется в нескольких случаях:
• Когда величина Δ H очень мала. На практике это не реализуется, т.к. твердофазовые реакции – экзотермические, их теплота – большая.
• Если в ходе твердофазовой реакции образуются твердые растворы, газовая или жидкая фазы. В этом случае увеличивается энтропия. Реализуется условие, Δ G стремится к 0. Такой случай реализуется часто.
• Равновесие достигается, если существует большая разница между теплоемкостью исходных веществ и продуктов реакции.
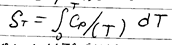
Такое условие не реализуется на практике.
Вывод: равновесие при твердофазовой реакции устанавливается, если в ходе реакции образуются твердые растворы, выделяется большое количество жидкости или газообразной фазы: А + В ↔ АВ
Если этого не происходит, то реакция идет, до тех пор, пока не израсходуется какой-либо исходный компонент.
2) Диаграмма состояния трехкомпонентной системы с эвтектикой. Эвтектический состав и эвтектическая температура, пограничные кривые. Правила определения характера пограничных кривых, состава первичной выпадающей при кристаллизации фазы, температуры начала кристаллизации, начального пути изменения состава жидкой фазы при кристаллизации. Применение правила рычага в этой системе.
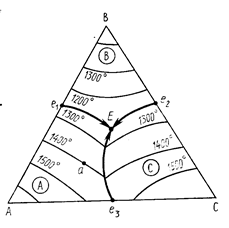
В точке эвтектики при отводе теплоты происходит физический процесс кристаллизации твердых фаз (соединений). Эвтектическая температура – температура, соответствующая эвт., составу.
Пограничные кривые – это кривые, разделяющие 2 поля первичной кристаллизации. Показывают состав жидкой фазы, находящейся в равновесии с двумя кристаллическими. На них система моновариантна. Два вида кривых Конгруэнтные и инкогруэнтные. На кривых обозначается стрелками падение температур.
Правило определения характера пограничных кривых:
Для определения характера пограничной кривой (конгруэнтная или инконгруэнтная) на каком-либо ее участке необходимо в точках, ограничивающих этот участок, провести касательные в этой кривой. Если касательные пересекают соответствующую соединительную прямую, соединяющую точки состава твердых фаз, находящихся в равновесии вдоль этой пограничной кривой, то она будет на данном участке конгруэнтной, а если не пересекает, то инконгруэнтной. Одна и та же кривая на разных участках может иметь различный характер.
Правило определения состава первичной фазы.
Первично выпадающей фазой будут кристаллы того соединение, в поле первичной кристаллизации которого находится точка состава.
Правило определения температуры начала кристаллизации.
Температурой начала кристаллизации будет температура той изотермы, на которую попала точка исходного расплава.
Правило определения начального изменения состава жидкой фазы.
Первичный путь кристаллизации пойдет по прямой, соединяющей точку исходного состава с точкой состава первичной выпадающей фазы в сторону уменьшения температуры.
Применение правила рычага в этой системе.

• определение количественного содержания фаз, образовавшихся за весь путь кристаллизации, при наличии в системе жидкой и одной твердой фазы.
Состав М охлажден до t2. В равновесии находятся ж., фаза состава m и кристаллы А:
Содержание ж., фазы = (М-АС)/(АС-m)*100 %
Содержание АС = (M-m)/(АС-m)*100%
• определение количественного содержания находящихся в равновесии двух твердых фаз с жидкостью.
Соответствует случаю, когда точка состава жидкой фазы находится на пограничной кривой. Кристаллизация того же состава М продолжалась до температуры t3. Сначала определяется содержание всей жидкой и твердой фаз, а затем содержание В и АС в отдельности. Построения на диаграмме: соединяем точку состава ж., фазы n с точкой исходного состава М и продолжаем эту прямую до пересечения с соединительной линией АС-В, соответствующей пограничной кривой Е1Е2. Точка пересечения k, будет характеризовать суммарный состав твердой фазы (В + АС). Длины отрезков k-AC, k-B – будут определять содержание в твердой фазе кристаллов АС и В.
- содержание ж., фазы = Mk/kn *100%;
- (B + AC) = Mn/kn*100%
- AC = (k-B)/(AC-B)*100%
- B = (k-AC)/(AC-B)*100%
• определение количественного содержания фаз, выделяющихся при данной температуре.
Для определения необходимо в каждый момент к пограничной кривой в точке, соответствующей температуре, провести касательную и пролжить ее до пересечения с соотв., этой кривой соединительной прямой. Точка пересечения разделит ее на отрезуи, пропорциональные соотношению кристаллизующихся фаз. Например,
АС/В = k’B/(k’-AC)