
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Первое начало термодинамики
|
|
Изменить внутреннюю энергию термодинамической системы можно двумя способами: путем совершения работы и путем теплообмена.
В любом случае: ∆ U=U2 – U1 ∆ U=Q2 – Q1
Работа считается положительной, если она совершается против внешних сил
Q = ∆ U + A – первое начало термодинамики – теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и совершение работы против внешних сил – есть закон сохранения энергии.
Дифференциальная форма этого закона: 
где δ Q – бесконечно малое количество теплоты; d U – бесконечно малое изменение энергии; δ А – элементарная работа.
Найдем работу, совершаемую газом при расширении. Рассмотрим газ, находящийся под площадью S в цилиндрическом сосуде. Газ, расширяясь совершает работу δ А=Fdl=pSdl=pdV, где F – сила, с которой газ действует на поршень, dl –перемещение поршня. Произведенную работу можно изобразить графически с помощью кривой в координатах 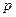 и V.
и V.

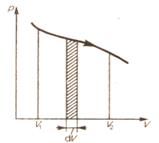
Рис.23 Рис.24
Элементарная работа равна pdV. Полная работа равна площади фигуры, ограниченной осью абсцисс, кривой p (V) и прямыми V 1 и V 2 или 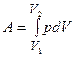 .
.