
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ферменты. Ферменты-белки, ускоряющие химические реакции
|
|
Ферменты -белки, ускоряющие химические реакции. Все ферменты- это глобулярные белки. При реакции не расходуются. Обладают всеми свойствами белков.
Кроме ферментов каталитической активностью обладают некоторые РНК (рибозимы).
Отличаются:
1.Специфичность действия.
2.Высокая эффективность действия.
3.Способность к регулированию.
Есть 6 классов ферментов.
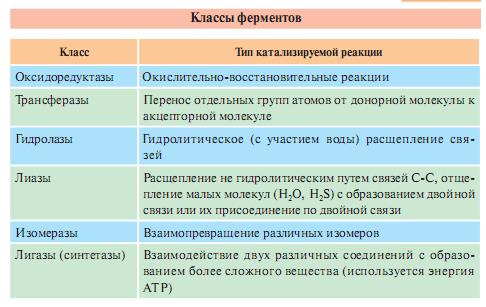
Классы ферментов:
1.Оксиредуктазы-катализируют ОВР с участием 2 субстратов (перенос электронов или атомов водорода с одного субстрата на другой).
-Дегидрогеназы- катализируют реакции отщепления водорода (дегидрирование). В качестве акцептора электронов выступают NAD+, NADP+, FAD, FMN.
-Оксидазы-акцептором электрона служит молекулярный кислород.
-Оксигеназы (гидроксилазы)-атом кислорода из молекулы кислорода присоединяется к субстрату.
2.Трансферазы-катализируют пренос функциональных групп от одного соединения к другому. Подразделяются в зависимости от переносимых групп.
3.Гидролазы-катализируют реакции гидролиза (расщепление ковалентной связи с присоединением молекулы воды по месту разрыва).
4.Лиазы-отщепление от субстрата негидролитическим путем определенной группы (CO2, H2O, NH2, SH2).
5.Изомеразы- катализируют различные внутримолекулярные превращения. Если переносится группа внутри одной молекулы, то фермент называют мутазой.
6.Лигазы (синтетазы)- реакции присоединения друг к другу 2 молекул с образованием ковалентной связи. Процесс сопряжен с разрывом связи АТФ или другого макроэргического соединения. Если АТФ-синтетаза, если не АТФ-синтаза.
Активный центр фермента -совокупность участка связывания субстрата и каталитического участка. Состоит из аминокислотных остатков.
Участок связывания субстрата - участок в котором субстрат при помощи нековалентных связей связывается с ферментом, формируя фермент-субстратный комплекс.
Каталитический участок - участок в котором субстрат претерпевает химическое превращение в продукт.
Кофактор - небелковое соединение, переводящее фермент в активную форму (чаще всего это ионы металлов).
Кофермент - белковое соединение, переводящее фермент в активную форму (производное витаминов).
Кофакторы и коферменты либо формируют третичную структуры белка-фермента, что обеспечивает его специфичность к субстрату. Либо вовлекаются в реакцию в качестве дополнительного субстрата (в основном коферменты).
Механизм реакции фермента с субстратом:
1.Фермент связывается с субстратом в активном центре (у сложных белков в активном центре располагается кофактор).
2.В области активного центра происходит химическое превращение субстрата и, образуется продукт реакции.
3.Образовавшийся продукт реакции теряет комплементарность и отсоединяется от фермента.
Молекула каждого фермента имеет нужную для своего действия конформацию, только при определенных внешних условиях (РН, температура и т.д.).
Виды специфичности ферментов:
Субстратная специфичность:
1.Абсолютная- катализирует превращение только одного субстрата.
2.Групповая- катализирует однотипные превращения в нескольких структурно похожих субстратах.
3.Стереоспецифичность- при наличии у субстрата нескольких стереоизомеров, фермент проявляет абсолютную специфичность только к одному из них (D- сахара, L-аминокислоты, цис-транс-изомеры).
Каталитическая специфичность:
Катализ присоединенного субстрата по одному из возможных путей превращения. Одно и то же вещество может превращаться в разные продукты, по действием различных ферментов.
Каталитическая эффективность (число оборотов фермента)- количество молекул субстрата, превращенных в продукт с помощью одной молекулы фермента за 1 секунду.
Явление специфичности путей превращения- один и тот же субстрат может превращаться в разные вещества, под действием разных ферментов.
Скорость ферментативных реакций (V) измеряют по убыли субстрата (S) или приросту продукта (P) за единицу времени. Изменение скорости ферментативной реакции находится в прямой пропорциональной зависимости от изменения концентрации фермента при насыщающей концентрации субстрата.
При определенной концентрации субстрата (разной для различных ферментов), когда все молекулы фермента включены в фермент-субстратный комплекс, скорость реакции становится максимальной — Vмакс.
Vмакс. достигается при полном насыщении активныхцентров фермента молекулами субстрата.
Концентрацию субстрата, при которой достигается скорость реакции, рав-
ная половине Vмакс., называют константой Михаэлиса — Км