
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диаграмма Пурбе.
|
|
Диаграмма Пурбе представляет собой зависимость значений электродного потенциала окислительно-восстановительной системы (редокс-пары) от рН раствора. С помощью диаграммы Пурбе можно оценить термодинамическую устойчивость различных окислительно-восстановительных систем в водной среде.
На диаграмме Пурбе нанесены прямые изменения электродных потенциалов водородного и кислородного электродов.
При изменении РН раствора от 0 до 14 потенциал водородного электрода изменяется от 0 до – 0, 828В (прямая 1), потенциал кислородного электрода от 1, 229 до 0, 401В (прямая 2).
Этими прямыми на диаграмме ограничены области I, II, III.
Окислительно-восстановительные системы, потенциалы которых лежат в области I (т.е. больше, чем потенциал кислородного электрода), в водной среде термодинамически неустойчивы и их окисленная форма вступает во взаимодействие с молекулами воды H2O в кислых растворах и ОН- - ионами в нейтральных и щелочных растворах
Вода в этом случае выступает в качестве восстановителя, разлагаясь с выделением кислорода.
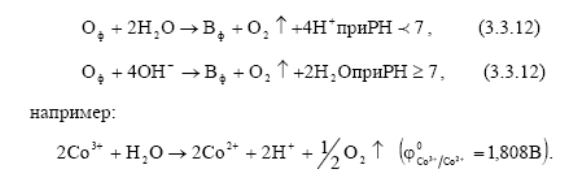
Область (II) – область электрохимической устойчивости воды – интервал потенциалов, в которой разложение воды в присутствии окислительно–восстановительных систем Оф│ Вф термодинамически невозможно.
Область (III) Окислительно-восстановительные системы, потенциалы которых лежат в области III (т.е. меньше потенциала водородного электрода), в водной среде термодинамически неустойчивы и их восстановленная форма вступает во взаимодействие с ионами Н+ в кислотных растворах, а в нейтральных и щелочных растворах - с молекулами воды, разлагая их. Вода в этом случае выступает в качестве окислителя, разлагаясь с выделением водорода. Этот случай называется «коррозией с водородной деполяризацией», которая происходит при взаимодействии H2O или иона Н+ с активными металлами.
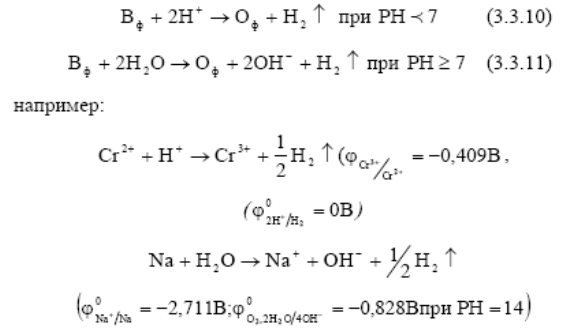
В области III возможна также коррозия с кислородной деполяризацией. Это происходит при наличии в растворе газообразного кислорода.
Термодинамика электрохимической коррозии металлов