
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Стандартный электродный потенциал металла.
|
|
Установившийся при достижении равновесия обратимый (или равновесный) электродный потенциал металла (φ Me)обр, являющийся разностью электрических потенциалов металла φ Ме и раствора φ р, можно рассчитать по термодинамическому уравнению Нернста.
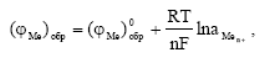
При температуре 250С и соответствующих значениях R и F, и коэффициенте перехода от натуральных логарифмов к десятичным уравнение Нернста записывается в следующем виде:
(φ Ме)обр = (φ Ме)0обр+ 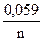 lgaМеn+
lgaМеn+
Первое слагаемое в уравнении (φ Ме)0обр – стандартный электродный потенциал металла: или обратимый потенциал металла при активности его ионов в растворе, равной единице.
Абсолютные значения стандартных потенциалов не определены экспериментально и не вычислены теоретически. Поэтому их определяют по отношению к стандартному (или нормальному) водородному электроду, потенциал которого условно (так как в разных растворителях он разный и зависит от температуры) принят равным нулю при любых температурах и в любых растворителях.
Обратимый электродный потенциал металла можно не только рассчитать по уравнению Нернста, но и определить экспериментально. Для этого нужно измерить электродвижущую силу элемента, составленного из исследуемого раствора (например, Ме в электролите) и электрода, потенциал которого условно принят за нуль (стандартного водородного электрода).
В окислительно-восстановительных реакциях Оф+ne = Вф присутствующие в растворе окисленные и восстановленные ионы образуют редоксипару. Количественную зависимость электродного потенциала от концентрации окислителя и восстановителя определяют по уравнению:
(φ Ме)обр = (φ Ме)0обр+ 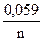 lg
lg 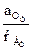 ,
,
Когда стехиометрические коэффициенты реакций перехода окисленной формы в восстановленную форму не равны единице, они входят в уравнение как показатель степени соответствующей концентрации (активности).
В справочниках приводят значения стандартных электродных потенциалов для различных редоксипар.