
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основы молекулярно-кинетической теории
|
|
Молекулярно-кинетическая теория - теория, объясняющая тепловые явления в макроскопических телах и свойства этих тел на основе их молекулярного строения.
Основные положения молекулярно-кинетической теории:
1. вещество состоит из частиц - молекул и атомов, разделенных промежутками,
2. эти частицы хаотически движутся,
3. частицы взаимодействуют друг с другом.
Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода: (атомная единица массы).
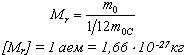
Количество вещества - это отношение числа молекул N в данном теле к числу атомов в 0, 012 кг углерода NA:
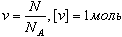
Моль - количество вещества, содержащего столько молекул, сколько содержится атомов в 0, 012 кг углерода.
Число молекул или атомов в 1 моле вещества называют постоянной Авогадро:
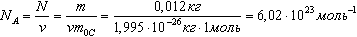
Молярная масса - масса 1 моля вещества:
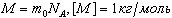
Молярная и относительная молекулярная массы вещества связаны соотношением: М = Мr*10 -3 кг/моль.
Газовые законы были получены эмпирически для равновесного состояния:
закон Бойля—Мариотта, который выполняется при постоянной температуре Т, имеет для 1 моля идеального газа следующий вид: 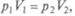 т. е. описывается изотермой на pV- диаграмме;
т. е. описывается изотермой на pV- диаграмме;
закон Гей-Люссака — изменение объема при температуре Т, постоянном давлении 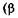 — коэффициент объемного расширения газа):
— коэффициент объемного расширения газа): 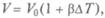 т.е. описываемом изобарой (рис. 4.4);
т.е. описываемом изобарой (рис. 4.4);
закон Шарля - изменение давления и температуры T при постоянном объеме 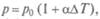 т.е. изохорный процесс. Здесь
т.е. изохорный процесс. Здесь 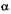 — термический коэффициент давления.
— термический коэффициент давления.
Уравнение состояния, введенное Клапейроном, для заданной массы газа объединяет три газовых закона, связывая между собой параметры газа. Клапейрон впервые употребил и графическое изображение обратимых циклических процессов, вычислив работу как соответствующую площадь на графике. Согласно закону Авогадро, количества любых газов при одинаковых температуре и давлении занимают одинаковый объем, который при нормальных условиях равен 22, 4 л = 22, 4 • 10-3 м3. Д. И. Менделеев обобщил с учетом закона Авогадро уравнение Клапейрона: pV= 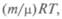 где m — масса газа; μ — его молекулярная масса; R — универсальная газовая постоянная, равная 8, 31 Дж/(мольК).
где m — масса газа; μ — его молекулярная масса; R — универсальная газовая постоянная, равная 8, 31 Дж/(мольК).
Газовые законы, как всякие эмпирические, справедливы приблизительно и описывают поведение почти идеальных газов при невысоких давлениях и не слишком высоких температурах. Подобных универсальных законов нет для жидкостей или твердых тел. Их свойства зависят от типа частиц, из которых они состоят, и силы взаимодействия между частицами в них меняются в широких пределах. Опыт показывает, что эти силы, имеющие отчасти характер электростатического взаимодействия, при расстояниях между молекулами более 10-9 м убывают столь быстро, что ими можно пренебречь. Поэтому свойства идеальных газов близки к свойствам реального газа.
Вопрос 12: