
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основное уравнение МКТ газа
|
|
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р - давление, V - объем, Т - температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
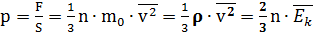
где
р - давление газа на стенки сосуда(Па)
n - концентрация молекул, т.е. число молекул в единице объема (1/м3)
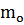 - масса молекулы (кг)
- масса молекулы (кг)
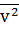 - средний квадрат скорости молекул (м2/с2)
- средний квадрат скорости молекул (м2/с2)
ρ - плотность газа (кг/м3)
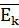 - средняя кинетическая энергия молекул (Дж)
- средняя кинетическая энергия молекул (Дж)
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
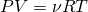
Где 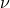 у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
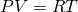
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
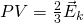
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
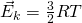
Но средняя кинетическая энергия, так же находится, как:
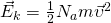
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат, Число Авогадро на массу молекулы, получается Молярная масса 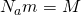 то у нас и получится формула для средней квадратичной скорости молекулы газа:
то у нас и получится формула для средней квадратичной скорости молекулы газа:
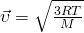
А если расписать универсальную газовую постоянную, как 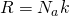 , и за одно молярную массу
, и за одно молярную массу 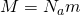 , то у нас получится?
, то у нас получится?
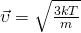
В Формуле мы использовали:
 — Средняя квадратичная скорость молекул
— Средняя квадратичная скорость молекул
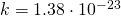 — Постоянная Больцмана
— Постоянная Больцмана
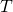 — Температура
— Температура
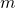 — Масса одной молекулы
— Масса одной молекулы
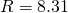 — Универсальная газовая постоянная
— Универсальная газовая постоянная
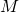 — Молярная масса
— Молярная масса
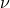 — Количество вещества
— Количество вещества
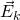 — Средняя кинетическая энергия молекул
— Средняя кинетическая энергия молекул
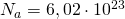 — Число Авогадро
— Число Авогадро
Вопрос 14:
Барометрическая формула— определяет зависимость давления или плотности газа от высоты в поле тяжести
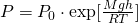
Давайте теперь узнаем, откуда же получается барометрическая формула. Давление газа на некой высоте, определяется как:

Теперь возьмем колонну в атмосфере и выделим в ней тонкий слой воздуха высотой dh. Ясно, что такой слой вызывает изменение давления на величину dP:
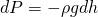
Знак минус необходим для того, что с увеличением высоты давление уменьшается
Рассматривая атмосферный воздух как идеальный газ, можно воспользоваться уравнением Менделеева — Клапейрона
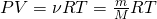
Из этого уравнения выражаем давление
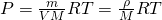
А теперь можно и плотность газа
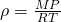
Подставляя найденную плотность газа в дифференциальное уравнение dP, мы получаем:
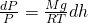
Сделав все преобразования. мы получаем зависимость давления P от высоты подъема h. Теперь необходимо проинтегрировать обе части нашего уравнения:
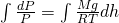
Проинтегрировав, у нас полечилась вот такое уравнение:
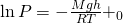
И теперь последний рывок, это взять логарифм. И у нас получится Барометрическое уравнение.
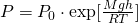
В Формуле мы использовали:
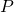 — Давление газа (атмосферное)
— Давление газа (атмосферное)
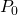 — Давление газа над уровнем моря
— Давление газа над уровнем моря
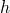 — Высота над уровнем моря
— Высота над уровнем моря
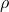 — Плотность газа
— Плотность газа
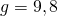 — Ускорение свободного падения
— Ускорение свободного падения
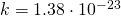 — Постоянная Больцмана
— Постоянная Больцмана
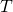 — Температура
— Температура
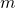 — Масса одной молекулы
— Масса одной молекулы
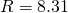 — Универсальная газовая постоянная
— Универсальная газовая постоянная
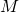 — Молярная масса
— Молярная масса
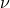 — Количество вещества
— Количество вещества
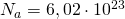 — Число Авогадро
— Число Авогадро
Максвелла распределение
Ма́ ксвелла распределе́ ние, распределение по скоростям частиц (молекул) макроскопической физической системы, находящейся в состоянии термодинамического равновесия, (в отсутствии внешнего поля, при условии, что движение частиц подчиняется законам классической механики. Установлено Дж. К. Максвеллом в 1859.
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv и имеет смысл плотности вероятности.
Для газа, подчиняющегося классической механике, в состоянии статистического равновесия функция распределения f Максвелла по скоростям имеет вид:
f(v) =n(m/2pkT)3/2exp(-mv2/2kT),
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Значение функции распределения f(v) зависит от рода газа (от массы молекул) и от температуры.
С помощью распределения Максвелла можно вычислять средние значения скоростей молекул и любых функций этих скоростей. В частности, средняя квадратичная скорость v2 =3kT/m, а средняя скорость молекулы v = (8kT/pm)1/2.
Распределение Максвелла не зависит от взаимодействия между молекулами и справедливо не только для газов, но и для жидкостей, если для них возможно применить классическое описание.
Распределение Максвелла вытекает из Гиббса распределения канонического в том случае, когда поступательное движение частиц можно рассматривать в классическом приближении, учитывая, что распределение по скоростям не зависит от распределения по пространственным координатам. Распределение Максвелла является частным решением кинетического уравнения Больцмана для случая статистического равновесия в отсутствии внешних полей. Распределение Максвелла не зависит от характера взаимодействия частиц системы и от внешних сил и потому справедливо как для молекул газа, так и для молекул жидкостей и твердых тел. Распределение Максвелла справедливо также для случая броуновского движения частиц, взвешенных в газе или жидкости.
Вопрос 15: