
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ІІІ. Реакції окислення
|
|
1. Горіння (повне окислення)
Спирти горять на повітрі з виділенням великої кількості тепла
tº
С2Н5ОН + 3О2  2СО2 + 3Н2О; Δ Н = - 1374 кДж
2СО2 + 3Н2О; Δ Н = - 1374 кДж
2. Неповне окислення під дією окислювачів: кисню повітря в присутності каталізатора, перманганату калію, дихромату калію та ін.
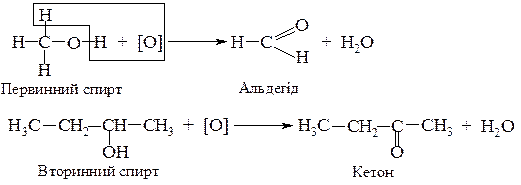
Таким чином, реакції дегідрування спиртів за своєю хімічною сутністю є реакціями окислення.
Способи одержання спиртів
1. Гідратація алкенів (приєднання води до алкенів)
H2C=CH2 + H2 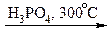 CH3− CH2OH
CH3− CH2OH
Етилен Етанол
Крім прямої гідратації етилену, існує також сульфатнокисла гідратація, яка протікає в дві стадії:
– на першій стадії етилен поглинається сульфатною кислотою:
tº
Н2С=СН2 + Н2SO4  CH3–CH2–OSO3H
CH3–CH2–OSO3H
– на другій стадії етилсірчана кислота гідролізується з утворенням етилового спирту і Н2SО4:
tº
CH3–CH2–OSO3H + H2O  CH3CH2OH + H2SO4
CH3CH2OH + H2SO4
При гідратації гомологів етилену згідно з правилом Марковнікова утворюються вторинні або третинні спирти:
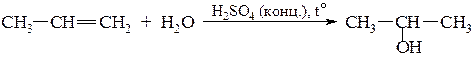
Пропен Пропанол–2