
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Установление константы диссоциации слабой кислоты методом ЭДС
|
|
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Константу диссоциации слабой кислоты можно определить путем измерения электропроводности её раствора или измерения ЭДС гальванического элемента, электроды которого обратимы относительно аниона и катиона этой кислоты. При использовании в эксперименте растворов кислоты с концентрацией не более 0, 1N (ионная сила растворов I ~ 0, 1) разница в коэффициентах активности катиона g+ и аниона g- не превышает 0, 01, т.е. можно принять g+ = g- = 0, 907. В этом случае для определения активности ионов водорода 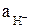 можно воспользоваться рН-метром, в котором используется стеклянный электрод, обратимый относительно Н+-ионов.
можно воспользоваться рН-метром, в котором используется стеклянный электрод, обратимый относительно Н+-ионов.
Одноосновная кислота НА диссоциирует по уравнению
НА 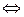 Н + + А– . (1)
Н + + А– . (1)
Выражение для термодинамической константы диссоциации имеет вид
Ka =  , (2)
, (2)
где  – активности катиона и аниона кислоты, аНA – активность молекулярной формы кислоты в растворе.
– активности катиона и аниона кислоты, аНA – активность молекулярной формы кислоты в растворе.
Известно, что активность а любой формы вещества в растворе связана с её концентрацией с уравнением a = c g, где g – коэффициент активности.
Равновесную концентрацию молекулярной формы слабой кислоты с учетом её диссоциации можно представить уравнением
сНA = 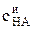 (1– a), (3)
(1– a), (3)
где 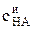 – исходная задаваемая концентрация кислоты, a – степень диссоциации.
– исходная задаваемая концентрация кислоты, a – степень диссоциации.
С использованием степени диссоциации уравнение (2) можно преобразовать к виду
Ka =  . (4)
. (4)
Для растворов слабой кислоты средних значений концентраций (0, 01–0, 1) можно принять a< < l, коэффициент активности молекулярной формы gНА=1 и коэффициенты активности катиона и аниона кислоты равными 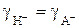 . В этом случае получаем
. В этом случае получаем 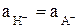 , и, преобразовав уравнение (4), получим
, и, преобразовав уравнение (4), получим
Ka = 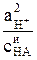 . (5)
. (5)
Следовательно, задавая исходную концентрацию кислоты в растворе и определяя экспериментально рН = – lg 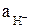 раствора, можно рассчитать Ка исследуемой кислоты по уравнению
раствора, можно рассчитать Ка исследуемой кислоты по уравнению
Ka =  . (6)
. (6)
Уравнение (2) можно также преобразовать к виду
Ka = 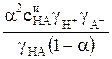 =
= 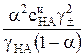
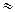
 = Кс
= Кс 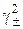 , (7)
, (7)
где 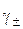 =
= 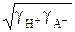 – средний коэффициент активности электролита,
– средний коэффициент активности электролита,
Кс = 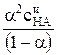 – концентрационная константа диссоциации.
– концентрационная константа диссоциации.
Используя справочные значения коэффициентов активности катиона и аниона кислоты, приведенные в таблице 1 по уравнению (7) можно рассчитать Кс, а затем, исходя из полученного значения Кс – величину степени диссоциации по уравнению a = 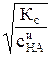 ,
,
где учтено, что a< < l.
Таблица 1. Справочные значения коэффициентов активности катиона и аниона кислоты
| С, моль/л | 0, 01 | 0, 025 | 0, 05 | 0, 1 |

| 0, 914 | 0, 88 | 0, 86 | 0, 83 |

| 0, 902 | 0, 86 | 0, 82 | 0, 78 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порядок выполнения работы
1. Готовят растворы уксусной кислоты с концентрацией 0, 01; 0, 025; 0, 05 и
0, 1 моль/дм3. Объем раствора 50 см3.
2. Проверяют достоверность показаний рН метра, используя стандартные буферные растворы.
3. Измеряют рН приготовленных растворов кислоты, начиная с раствора меньшей концентрации.
Обработка результатов опыта
1. Рассчитывают значения Ка по уравнению (6) для каждого приготовленного раствора и находят её среднюю величину.
2. Рассчитывают концентрационную константу диссоциации Кс и степень диссоциации кислоты a для каждого приготовленного раствора.
3. Полученные данные заносят в таблицу 2.
Таблица 2. Измеренные и рассчитанные результаты.
| С, моль/л | рН | Ка | g± | Кс | a |
По результатам работы делают выводы и вычисляют абсолютную и относительную ошибки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Величины, характеризующие процесс диссоциации.
2. Написать выражение для константы диссоциации.
3. Чем отличаются слабые и сильные электролиты?
4. Как выражается средний коэффициент активности электролита через коэффициенты активности ионов?
5. Дать определение концентрационной константы равновесия процесса диссоциации.
6. Как связаны концентрационная и термодинамическая константы равновесия процесса диссоциации?
7. Как рассчитать ионную силу раствора электролита?
8. Дать определение рН раствора. Зависит ли рН от температуры.
9. Размерности величин в уравнениях.