
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Произведение растворимости. Понятие произведения растворимости связано с насыщенными растворами малорастворимых сильных электролитов
|
|
Понятие произведения растворимости связано с насыщенными растворами малорастворимых сильных электролитов, как правило, солей. Большинство труднорастворимых электролитов в очень разбавленных растворах диссоциируют полностью, т.е. их можно рассматривать как сильные электролиты. Поэтому все приведенные ниже рассуждения относятся не только к растворам солей, но и к растворам оснований, таких как Al(OH)3, Fe(OH)3, Cu(OH)2 и др.
В случае низкой растворимости электролита образуется крайне разбавленный раствор, который близок к идеальному раствору и можно использовать концентрационную константу равновесия: Кс = 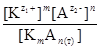 .
.
Концентрация твердой фазы [К m А n (т)]=const, отсюда:
Кс [К m А n (т)] = [ 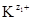 ] m [
] m [ 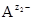 ] n = ПР = const. (9)
] n = ПР = const. (9)
При постоянной температуре в насыщенном растворе произведение концентраций (или активностей) ионов, на которые диссоциирует электролит, с учетом показателей степеней, соответствующих стехиометрическим коэффициентам, есть величина постоянная. Она называется произведением растворимости (ПР) малорастворимого сильного электролита.
Чем меньше значение ПР, тем хуже растворяется соединение. При внесении в раствор избытка ионов 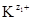 или
или 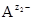 , изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка
, изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка
Условием образования осадка является превышение величины произведения концентраций ионов над величиной произведения растворимости:
Сm (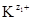 )× Сn (
)× Сn (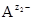 ) > ПР
) > ПР
Когда в растворе мала концентрация ионов, то Cm (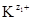 )× Cn (
)× Cn (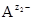 ) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.