
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Практична робота. Дослід 1. Визначення активності аланінамінотрансферази (АлАТ) уніфікованим динітрофенілгідразиновим методом Райтмана-Френкеля.
|
|
Дослід 1. Визначення активності аланінамінотрансферази (АлАТ) уніфікованим динітрофенілгідразиновим методом Райтмана-Френкеля.
Принцип методу. У результаті реакції трансамінування під дією АлАТ утворюються піруват і глутамат. При додаванні 2, 4-динітрофенілгідразину в лужному середовищі утворюється гідразон піровиноградної кислоти червоно-бурого забарвлення, інтенсивність якого прямопропорційна кількості утвореної піровиноградної кислоти і є показником активності АлАТ.
Матеріальне забезпечення: 0, 4 М розчин NаОН, субстратний розчин (29, 2 мг α -кетоглутарової кислоти і 1, 78 мг D, L-аланіну розчиняють в 1 М NаОН до отримання рН 7, 4, розчин переливають у мірну колбу на 100 мл і доводять 0, 1 М фосфатним буфером до мітки). 0, 1% розчин 2, 4-динітрофенілгідразину, фотоелектроколориметр, термостат або водяна баня, холодильник, штатив з пробірками, піпетки.
Хід роботи. А) Кількісне визначення піровиноградної кислоти:
У дві пробірки (дослідну і контрольну) вносять по 0, 5 мл свіжорозмороженого субстратного розчину і ставлять у термостат при температурі 370С на 5 хв. Потім у дослідну пробірку додають 0, 1 мл досліджуваної сироватки, а в контрольну – 0, 1 мл води і обидві пробірки ставлять в термостат при 370С на 30 хв. Після інкубації пробірки виймають та в обидві додають по 0, 5 мл розчину 2, 4-динітрофенілгідразину, перемішують і витримують 20 хв при кімнатній температурі. Потім додають в обидві пробірки по 5 мл 0, 4 М NaOН, перемішують і залишають на 10 хв при кімнатній температурі для розвитку забарвлення. Інтенсивність забарвлення визначають на фотоелектроколориметрі при зеленому світлофільтрі (λ = 500-560 нм) у кюветі з товщиною шару 10 мм проти контрольної проби.
Кількість утвореної піровиноградної кислоти (у мкг) знаходять за калібрувальним графіком або за формулою І:
А
 Х = (I)
Х = (I)
0, 09
де: А – визначена оптична густина.
В) Активність АлАТ вираховують за формулою ІІ:
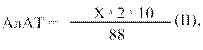
де: Х – кількість піровиноградної кислоти, знайденої за калібрувальним графіком або за формулою І, мкг;
2 – коефіцієнт перерахунку на 1 год інкубації;
10 – коефіцієнт перерахунку на 1 мл сироватки;
88 – маса 1 мкмоль піровиноградної кислоти.
Зробити висновок.
Клініко-діагностичне значення. Активність АсАТ у крові зростає через 4-6 год. після інфаркту міокарда і звичайно повертається до норми на 3-7 день. При стенокардії АсАТ залишається в нормі. Зниження нормальних показників амінотрансфераз у плазмі може бути при недостатності вітаміну В6, а також при нирковій недостатності. Найвища активність АлАТ характерна для захворювань печінки – особливо в інкубаційному періоді інфекційного гепатиту.
Зростання активності ферментів у сироватці крові викликають некроз печінки або їх пошкодження будь-якої етіології, включаючи холестатичну і обструктивну жовтяницю, хронічні гепатити, алкогольний гепатит (АсАТ зазвичай більше АлАТ); вірусні і хронічні гепатити (АлАТ > АсАТ), метастази в печінку і гепатома; інфекційний мононуклеоз; некроз, травма, запальні захворювання серцевого або скелетного м’язу; після гострого інфаркту міокарда АсАТ > АлАТ; тяжке фізичне навантаження, серцева недостатність, тяжкі опіки, тепловий удар, гіпотиреоідизм, молочнокислий ацидоз та ін.
Нормальні значення або незначне підвищення спостерігається при цирозі печінки, неврологічних захворюваннях, церебральному інфаркті, гострому панкреатиті, гемофілії, порушенні процесів всмоктування в кишківнику, ожирінні та ін.
Діагностично важливим є одночасне визначення активності АлАТ і АсАТ та розрахунок коефіцієнта де Рітіса – АсАТ/АлАТ, який в нормі дорівнює приблизно 1, 3. При інфекційному гепатиті він нижчий норми, при інфаркті міокарда – вищий норми.
Нормативні величини: для АлАТ – 28-190 нмоль/(с·л)
[0, 1-0, 68 мкмоль/(год.мл)] при 37 оС або 11, 4 МО/л.
Дослід 2. Уніфікований метод визначення креатиніну за кольоровою реакцією Яффе (метод Поппера і співавторів)
Принцип методу. В результаті реакції креатиніну і пікринової кислоти в лужному середовищі утворюється кольорова сполука, інтенсивність забарвлення якої прямопропорційна концентрації креатиніну.
Матеріальне забезпечення: Насичений розчин пікринової кислоти (2 г пікринової кислоти розчиняють в 100 мл гарячої (70-80оС) дистильованої води) залишають на добу при кімнатній температурі, фільтрують, зберігають у темному посуді; основний стандартний розчин креатиніну (8, 8 мМ 100 мг креатиніну розчиняють в 100 мл 0, 1 н розчину хлоридної кислоти) зберігають у холодильнику з притертим корком; розчин їдкого натрію – 10 г/100 мл; 0, 1 н розчин хлоридної кислоти; центрифуга, водяна лазня, фотоелектроколориметр або спектрофотометр.
Хід роботи: 2 мл сироватки змішують в пробірці з 6 мл прозорого насиченого розчину пікринової кислоти. Через 5 хв пробірку поміщають на 15-20 с в кип’ячу водяну баню, потім вміст пробірки центрифугують (або фільтрують). До 4 мл супернатанту додають 0, 2 мл розчину NаОН, перемішують і доводять водою до 10 мл. Через 10 хв проби колориметрують при зеленому світлофільтрі (довжина хвилі 530 нм) у кюветі з товщиною шару 20 мм проти контрольної проби. Контрольну пробу готують наступним чином: до 3 мл насиченого розчину пікринової кислоти додають 0, 2 мл розчину NаОН і доводять водою до 10 мл. Стандартну пробу готують аналогічно до дослідної, але з тою різницею, що замість сироватки беруть 2 мл робочого стандартного розчину і вміст пробірки не центрифугують.
Розраховують концентрацію креатиніну (Х) за формулою:
| Х = | Адосл . Аст. | × 0, 088 ммоль/л |
| Х = | Адосл . Аст. | × 88 (мкмоль/л) |
або
де: Адосл. – екстинкція дослідної проби;
Аст. – екстинкція стандартної проби;
0, 088 ммоль/л (88 мкмоль/л) – концентрація креатиніну в стандартній пробі.
Зробити висновки.
Клініко-діагностичне значення. Креатинін – кінцевий продукт обміну креатину. Концентрація креатиніну в крові є досить постійною величиною, що відображає м’язову масу і не залежить від харчування та інших факторів. Креатинін не реабсорбується в ниркових канальцях, тому з діагностичною метою використовується його визначення в крові та сечі для оцінки швидкості клубочкової фільтрації нирок.
У нормі вміст креатиніну у жінок – 0, 044-0.097 ммоль/л або 44-97 мкмоль/л; у чоловіків – 0, 044-0, 115 ммоль/л або 44-115 мкмоль/л. Підвищені показники можуть бути на фоні приймання нефротоксичних препаратів, при лейкемії, гемолізі, кетоацидозі, занижені – при жовтяниці.
Підвищена концентрація креатиніну в крові спостерігається при гострих і хронічних захворюваннях нирок, активній акромегалії, гігантизмі, гіпертиреозі. Зниження даного показника може спостерігатись протягом І і ІІ триместрів вагітності, а також при зменшенні м’язової маси (обумовленому віком або м’язовою дистрофією).
Контроль виконання лабораторної роботи
1. При визначенні активності АлАТ уніфікованим динітрофенілгідразиновим методом Райтмана-Френкеля як субстратну суміш використовують:
A. α - Кетоглутарат і аланін
B. α - Кетоглутарат і гліцин
C. α - Кетоглутарат і аспартат
D. Оксалоацетат і аланін
E. Оксалоацетат і глутамат
2. Гідразон піровиноградної кислоти в лужному середовищі утворює червоно-буре забарвлення, інтенсивність якого є прямопропорційною кількості:
A. Пірувату
B. Оксалоацетату
C. α - Кетоглутарату
D. Аланіну
E. Аспартату
3. У результаті реакції креатиніну і пікринової кислоти в лужному середовищі утворюється кольорова сполука, інтенсивність забарвлення якої є прямопропорційною концентрації:
A. Креатиніну
B. Креатину
C. α - Кетоглутарату
D. Аланіну
E. Аспартату
4. Нормативні величини креатиніну для жінок складають:
A. 0, 044-0, 097 ммоль/л
B. 0, 440-0, 970 ммоль/л
C. 4, 400-9, 700 ммоль/л
D. 44, 000-97, 000 ммоль/л
E. 440, 000-970, 000 ммоль/л
5. Хворий 55 років госпіталізований зі скаргами на болі в лівій половині грудної клітки, задишку в стані спокою з діагнозом – інфаркт міокарда. Результати лабораторних аналізів: креатинкіназа - 12 мкмоль/хв.л) (норма 0-6); АсАТ - 60 мкмоль/(хв.л) (норма 2-20); ЛДГ - 15 мкмоль/(год.мл) (норма 8, 8-4, 0). Чи підтверджується діагноз на основі проведеного лабораторного обстеження?
Приклади тестів „Крок-1”
1.У хворого 60 років є клінічні ознаки інфаркту міокарда. Визначення активності яких ферментів сироватки крові підтвердять діагноз?
A. Трансаміназа, креатинкіназа, лактатдегідрогеназа
B. Трансаміназа, креатинкіназа, глутаматдегідрогеназа
C. Креатинкіназа, ліпаза, глутатіопероксидаза
D. Лактатдегідрогеназа, трансаміназа, амілаза
E. Глікозидаза, амілаза, супероксиддисмутаза
2. Хворий 30 років, спортсмен, після чергового тренування знепритомнів. До цього виникали болі в області серця. Хворому попередньо поставлено діагноз інфаркт міокарду. Визначення активності якого ферменту необхідно провести для уточнення діагнозу?
A. Альдолази
B. АсАТ
C. Лужної фосфатази
D. Холінестерази
E. Кислої фосфатази
3. Хворий 45 років скаржиться на загальну слабість, швидку стомлюваність. При аналізі крові встановлено зниження активності амінотрансфераз та декарбоксилаз амінокислот. Хворому потрібно призначити:
A. Тіамін
B. Рибофлавін
C. Піридоксальфосфат
D. Фолієву кислот
E. Нікотинамід
4. До лікаря звернувся хворий, у якого виражені алергічні симптоми: висипи на тілі, набряки обличчя, свербіння. Це пов’язано зі збільшенням утворення:
A. Холіну
B. ГАМК
C. Дофаміну
D. Гістаміну
E. Серотоніну
5. До лікаря звернулась хвора з термічним опіком. У сироватці крові хворої спостерігається:
A. Підвищення концентрації ГАМК
B. Зниження концентрації ГАМК
C. Підвищення концентрації дофаміну
D. Підвищення концентрації гістаміну
E. Зниження концентрації гістаміну
Індивідуальна самостійна робота студентів
1. Клініко-діагностичне значення визначення трансаміназ.
2. Синтез та розпад біогенних амінів.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С.234-242.
2. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – С.406-419.
3. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С.146-152.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Київ: Медицина, 2010. – С.188-193.
5. Скляров О.Я., Сольскі Я., Великий М.М. та ін.. Біохімія ензимів. Ензимодіагностика. Ензимопатологія. Ензимотерапія. – Львів: Кварт, 2008. – 218 с.
6. Клінічна біохімія: Підручник / За ред. проф. Склярова О.Я. – Львів, 2006. – С.82-116.
Додаткова:
1. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – Київ: Медицина, 2007. – 318 с.
2. Ангельскі С., Якубовскі З., Домінічак М. Г. Клінічна біохімія. – Сопот, 1998. – 451 с.
3. Березов Т. Т., Коровкин Б. Ф. Биологическая химия. – М.: Медицина, 1990. – 528 с.
4. Кольман Я., Рем К.-Г. Наглядная биохимия. – Москва: Мир, 2000. – 470 с.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. – Москва: Мир, 2004. – С. 63-71, 79-83.
6. Справочник по лабораторным методам исследования. Под ред. проф. Л.А. Даниловой. – М. – С.-Пб. – Нижний Новгород – Воронеж – Ростов-на-Дону – Екатеринбург – Самара – Киев – Харьков – Минск: – 2003. – 733 с.
Тема № 9. Дослідження процесів детоксикації аміаку та біосинтезу сечовини.
Мета заняття: Знати шляхи утворення, транспортування та знешкодження аміаку в організмі людини. Засвоїти методи визначення сечовини, фенілпіровиноградної кислоти у біологічних рідинах, вміти інтерпретувати отримані дані.
Актуальність теми: В процесі обміну амінокислот утворюються метаболіти, визначення яких у крові та сечі може бути використано для діагностики і контролю за лікуванням.
Конкретні завдання:
Ø Кількісно визначити сечовину у біологічних рідинах. Дати оцінку проведеним дослідженням і зробити висновок;
Ø Трактувати метаболічні закономірності утворення та знешкодження аміаку, циркуляторного транспорту аміаку, біосинтезу сечовини;
Ø Аналізувати зміни в системах транспорту та знешкодження аміаку при генетичних аномаліях ферментів метаболізму аміаку;
Ø Пояснювати особливості функціонування загальних шляхів метаболізму безазотистих скелетів амінокислот та спеціалізованих перетворень циклічних амінокислот;
Ø Пояснювати біохімічні основи виникнення і проявів генетичних аномалій обміну циклічних амінокислот та аналізувати причини нагромадження проміжних продуктів їх обміну при фенілкетонурії, алкаптонурії, альбінізмі.
Теоретичні питання
1. Загальні шляхи метаболізму безазотистого скелета амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
2. Шляхи утворення аміаку. Токсичність аміаку та механізми його знешкодження. Циркуляторний транспорт аміаку (глутамін, аланін).
3. Біосинтез сечовини: ферментні реакції; генетичні дефекти ферментів (ензимопатії) синтезу сечовини.
4. Спеціалізовані шляхи обміну ациклічних амінокислот. Обмін гліцину та серину; роль тетрагідрофолату (H4-фолату) в переносі одновуглецевих фрагментів, інгібітори дигідрофолатредуктази як протипухлинні засоби.
5. Особливості обміну амінокислот з розгалуженими ланцюгами; участь коферментних форм вітаміну В12 в метаболізмі амінокислот.
6. Специфічні шляхи метаболізму циклічних амінокислот фенілаланіну та тирозину, послідовність ферментативних реакцій. Спадкові ензимопатії обміну циклічних ациклічних амінокислот фенілаланіну та тирозину – фенілкетонурія, алкаптонурія, альбінізм.