
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретична частина. Реакції, які супроводжуються зміною ступенів окиснення хімічних елементів, називають окисно-відновними.
|
|
Реакції, які супроводжуються зміною ступенів окиснення хімічних елементів, називають окисно-відновними.
Ступінь окислення (с.о.) – умовний заряд, який мав би атом, коли б електрони всіх його зв’язків з іншими атомами були зміщені до більш електронегативного атома.
У загальному випадку величину і знак с.о. атомів визначають, порівнюючи електронегативність елементів, які входять до складу сполуки. Найбільш електронегативний атом має негативний с.о., а атом з меншою електронегативністю – позитивний с.о. Оскільки величини електронегативностей атомів простих речовин однакові, то їх с.о. у цьому разі дорівнюють нулю (N2, H2, Cl2, F2). С.о. йонів у йонних сполуках дорівнюють величинам їх зарядів. Сума с.о. всіх атомів у молекулі має дорівнювати нулю. Так с.о. Карбону в наведених сполуках дорівнюють:  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  .
.
Для складання окисно-відновних реакцій (ОВР) застосовують метод електронного балансу. В ОВР число електронів, які втрачає відновник, дорівнює числу електронів, які приєднує окисник.
Розглянемо основні правила складання ОВР на прикладі взаємодії калій перманганату з калій нітритом в кислому середовищі. При цьому слід дотримуватися такої послідовності. Спочатку записують у молекулярній формі реагуючі речовини та визначають с.о. елементів, які можуть змінювати с.о. за певних умов, наприклад:

Потім визначають, яка сполука в реакції є окисником, а яка відновником. До окисників належать речовини, що мають здатність до приєднання електронів.
У наведеному прикладі KMnO4 містить Манган зі ступенем окиснення +7, і тому він може бути лише окисником. До відновників належать речовини, здатні віддавати електрони. Сполука KNO2, в якій Нітроген має проміжний с.о. +3, може бути як відновником так і окисником. Отже, у наведеній реакції KMnO4 – окисник, а KNO2 – відновник. KNO2 може окиснюватися лише до KNO3, а KMnО4 в кислому середовищі відновлюється до MnSO4:

Після цього визначають кількість електронів, які віддає відновник KNO2 та кількість електронів, які приєднує окисник KMnO4. Для цього складають рівняння, в яких кількість електронів, що приєднується або віддається, визначають як різницю між с.о. окисника і відновника до реакції і після неї:

Отже, відновлення Мангану  відповідає приєднанню п’яти електронів, а окиснення Нітрогену
відповідає приєднанню п’яти електронів, а окиснення Нітрогену  - віддачі двох електронів. Для балансу електронів (приєднується і віддається
- віддачі двох електронів. Для балансу електронів (приєднується і віддається 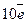 ) потрібно, щоб відновлення двох
) потрібно, щоб відновлення двох  у реакції витрачалося п’ять
у реакції витрачалося п’ять  , тобто коефіцієнти в рівнянні реакції біля окисника і відновника дворівнюватимуть двом і п’яти:
, тобто коефіцієнти в рівнянні реакції біля окисника і відновника дворівнюватимуть двом і п’яти:

Після цього розставляють коефіцієнти для інших речовин, що беруть участь у реакції. Причому спочатку знаходять коефіцієнти для всіх катіонів (крім Н+), а потім – для аніонів. Щоб урівняти для цієї реакції кількість йонів калію у лівій і правій частинах рівняння, потрібна одна молекула К2SO4, а для зв’язування всіх катіонів мангану і калію слід взяти три молекули H2SO4:
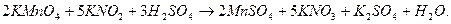 На основі балансу атомів гідрогену визначають кількість молекул води:
На основі балансу атомів гідрогену визначають кількість молекул води:

Кількість атомів Оксигену в ОВР не урівнюють, а баланс Оксигену використовують для перевірки знайдених коефіцієнтів.