
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретична частина. Електроліти– це речовини, розчини або розплави яких проводять електричний струм за рахунок дисоціації на йони.
|
|
Електроліти – це речовини, розчини або розплави яких проводять електричний струм за рахунок дисоціації на йони.
Дисоціація – розпад молекул, йонів, радикалів на частинки з меншою масою.
Речовини, які практично повністю дисоціюють на йони в розчинах, називаються сильними електролітами.
Електроліти, які частково дисоціюють або є нерозчинними, називаються слабкими електролітами.
Електроліти
| С И Л Ь Н І: 1. Розчинні у воді солі; 2. Кислоти: HNO3, HClO4, HCl, HBr, HJ, H2SO4 (за І ступенем дисоціації); 3. Гідроксиди лужних та лужно-земельних металів: LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 (за І ступенем дисоціації) | С Л А Б К І: 1. Малорозчинні у воді солі; 2. Більшість органічних кислот(СН3СООН); 3. H2CO3, H2SiO3, H2S, HCN, H3BO3, H2SO3; 4. NH4OHта малорозчинні у воді гідроксиди металів: Cu(OH)2, Fe(OH)3, Al(OH)3, Mg(OH)2, Pb(OH)2, Cr(OH)3 |
Кількісною характеристикою електролітичної дисоціації є ступінь дисоціації (α), який дорівнює відношенню числа дисоційованих молекул до загального числа молекул електроліту в розчині:
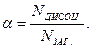
Процес дисоціації багатоосновних кислот та багатокислотних основ відбувається ступінчасто. Наприклад, дисоціація сульфітної кислоти відбувається таким чином:
І ступінь:  L
L 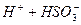 ;
;
ІІ ступінь: 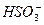 L
L 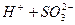 .
.
Константа рівноваги слабкого електроліту К називається константою дисоціації КДИС. Вона як і ступінь дисоціації є кількісною мірою здатності електроліту дисоціювати у розчині. Для розчину сульфітної кислоти, яка дисоціює за І ступенем, константа дисоціації має вираз:
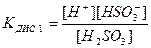 ;
;
К1 = 4, 5 . 10-7,
а за ІІ ступенем:
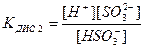 ;
;
К2 = 4, 8 . 10-7.
Чим менше значення КДИС., тим електроліт є слабкішим. Між константою дисоціації та ступенем дисоціації є зв’язок, відомий під назвою закону розбавлення Оствальда:
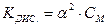 , звідки
, звідки 
Реакції обміну в розчинах електролітів відбуваються в напрямку утворення слабких електролітів, виділення газу і утворення осаду.