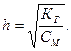Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретична частина. Гідроліз солі– це обмінна реакція йонів солі з молекулами води, в результаті чого утворюється слабкий електроліт і змінюється рН середовища.
|
|
Гідроліз солі – це обмінна реакція йонів солі з молекулами води, в результаті чого утворюється слабкий електроліт і змінюється рН середовища.
Гідролізуються лише ті солі, до складу яких входить залишок слабкого електроліту, наприклад NH4Cl:
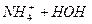 L
L  ,
,
 L
L  .
.
В результаті гідролізу цієї солі утворюється слабка основа NH4ОН і сильна кислота НС1, рН цього розчину буде кислим (рН < 7).
Солі, до складу яких входять багатозарядні залишки слабких електролітів, гідролізуються ступінчасто, наприклад К2СО3:
І ступінь:  L
L 
 L
L  ; рН > 7.
; рН > 7.
Як правило, самовільно гідроліз відбувається тільки за І ступенем. Щоб змістити йонну рівновагу і підсилити гідроліз цієї солі, необхідно додати сильну кислоту, щоб нейтралізувати лужну реакцію розчину.
ІІ ступінь: 

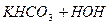
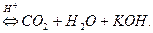
Продуктами повного гідролізу цієї солі буде слабка карбонатна кислота (СО2 + Н2О) і сильна основа КОН.
Якщо сіль утворена слабкою кислотою і слабкою основою, то гідроліз такої солі одночасно відбувається за катіоном і за аніоном, наприклад СН3COONH4:
 L
L  ,
,
 L
L  ,
,
 L
L  .
.
Реакція такої солі майже нейтральна.
Кількісно гідроліз солей характеризується величиною ступеня та константи гідролізу. Ступенем гідролізу (h) солі називається відношення молярної концентрації гідролізованої солі до загальної молярної концентрації солі в розчині:

Константа гідролізу солі тісно зв’язана з константою дисоціації слабкого електроліта, що утворюється в результаті гідролізу.

Ступінь та константа гідролізу солі зв’язані залежністю відповідно закону Оствальда: