
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теории полимолекулярной адсорбции
|
|
В точке А изотерма, показанная на рис. 4.5, круто поднимается кверху, что указывает на то, что связывание адсорбтива с адсорбентом после образования молекулярного слоя не прекращается.
Для объяснения этого Поляни в 1915 г. предложил теорию полимолекулярпой адсорбции, называемую также потенциальной.
Основные положения теории Поляни:
1)адсорбция обусловлена чисто физическими силами;
2)на поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи поверхности и образуют около этой поверхности непрерывное силовое поле;
3)адсорбционные силы действуют на сравнительно большие расстояния, превышающие размеры отдельных молекул адсорбтива и поэтому можно говорить о существовании у поверхности адсорбента адсорбционного объема, который заполняется молекулами адсорбтива;
4)действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю;
5)притяжение данной молекулы поверхностью адсорбента не зависит от наличия в адсорбционном пространстве других молекул;
6)адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не изменяется;
7)под воздействием адсорбционного поля возникает возможность образования нескольких слоев молекул адсорбата. Наибольшее притяжение и сжатие испытывает первый адсорбционный слой; газообразные продукты в нем конденсируются в жидкость. Притяжение последующих слоев снижается до тех пор, пока плотность вещества понизится до его плотности в окружающей среде.
Теория полимолекулярной адсорбции Поляни позволяет описать адсорбцию на пористых адсорбентах и качественно объяснить характер S-образной изотермы. Однако эта теория не привела к выводу уравнения, описывающего эту изотерму.
Брунауэр, Эммет и Теллер разработали теорию применительно к адсорбции паров. Эта теория получила название теории БЭТ в соответствии с начальными буквами фамилий авторов.
Эта теория основана на следующих положениях:
1)на поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров;
2)каждая молекула первого слоя представляет собой активный центр для дальнейшей адсорбции, что приводит к образованию второго, третьего и т. д. слоев. При этом построение последующих слоев возможно при незаполненном первом;
3)взаимодействием соседних адсорбированных молекул в рамках одного слоя пренебрегают;
4)молекулы адсорбтива в последующих слоях по сумме статистических состояний подобны молекулам жидкости и отличаются от молекул первого слоя. Таким образом, адсорбированная фаза может быть представлена как совокупность адсорбционных комплексов – молекулярных цепочек, начинающихся молекулами первого слоя, непосредственно связанными с поверхностью адсорбента. При этом цепочки не взаимодействуют между собой.
Схема полимолекулярной адсорбции по теории Бру-науэра, Эммета и Теллера представлена на рис. 4.6.

Рис. 4.6. Схема полимолекулярной адсорбции по теории БЕТ.

Итак, теория БЭТ исходит из наличия на поверхности адсорбента активных центров. В этом состоит ее сходство с теорией Ленгмюра. Вместе с тем, подобно теории Поляни, она допускает возможность образования нескольких адсорбционных слоев.
Авторы теории рассматривают адсорбцию как серию последовательных квазихимических реакций:
 Кр
Кр
 К1
К1
 К2 и т. д.,
К2 и т. д.,
где А – активный центр, В – молекула адсорбтива, Кр, K1, К2 – константы соответствующих адсорбционных равновесий.
Авторы теории приняли, что во всех слоях, кроме пер1вого, взаимодействуют между собой в основном молекулы адсорбата, как и при конденсации. Поэтому было принято, что:

где KL – константа конденсации пара, равная отношению активностей вещества в жидком состоянии аж и в состоянии насыщенного пара – аn, принято аж = 1 (стандартное состояние), а аn = pS.
Брунауэр, Эммет и Теллер вывели следующее уравнение изотермы адсорбции паров:
 (4.13)
(4.13)
В этом уравнении: pS – давление насыщенного пара при данной температуре, р/pS – относительное давление пара, С = Кр/KL.
Уравнение (4.13) называется уравнением полимолекулярной адсорбции БЭТ.
При малых значениях р, далеких от pS, т. е. при Р/PS< < 1, уравнение (4.13) превращается в уравнение мономолекулярной адсорбции Ленгмюра, а при дальнейшем уменьшении давления (р  0) переходит в закон Генри. По мере приближения р к pS число свободных активных центров уменьшается и кратность комплексов растет. При р = ps происходит объемная конденсация пара. Таким образом, уравнение БЭТ описывает всю S-образную изотерму адсорбции (см. рис. 4.5)/ Точка А на этой кривой отвечает завершению монослоя адсорбтива.
0) переходит в закон Генри. По мере приближения р к pS число свободных активных центров уменьшается и кратность комплексов растет. При р = ps происходит объемная конденсация пара. Таким образом, уравнение БЭТ описывает всю S-образную изотерму адсорбции (см. рис. 4.5)/ Точка А на этой кривой отвечает завершению монослоя адсорбтива.
На теории БЭТ основан стандартный метод измерения удельной поверхности адсорбентов, катализаторов, порошков и других материалов. Для этого используется уравнение БЭТ в линейной форме:
 (4.14)
(4.14)
По экспериментальным данным строят график в координатах 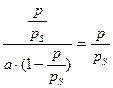 (рис. 4.7). Тангенс угла наклона прямой к оси абсцисс равен
(рис. 4.7). Тангенс угла наклона прямой к оси абсцисс равен  , а отрезок, отсекаемый на оси ординат, –
, а отрезок, отсекаемый на оси ординат, –  .
.
Из графика находят 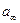 , а затем рассчитывают удельную поверхность:
, а затем рассчитывают удельную поверхность:
 , (4.15
, (4.15
где NA – число Авогадро, So – площадь, занимаемая одной молекулой адсорбтива.
В качестве адсорбтива обычно используют газы (азот, аргон, криптон), в которых межмолекулярное взаимодействие на поверхности адсорбента является слабым, что соответствует исходным допущениям теории. Принимаются следующие значения S0: азот – 0, 162 нм2, аргон – 0, 138 нм2, криптон – 0, 195 нм2.

Рис.4.7. Изотерма полимолекулярной адсорбции в координатах линейной формы уравнения БЭТ
Необходимо отметить, что, несмотря на ряд недостатков, связанных с допущениями, которые лежат в основе теории БЭТ, она является весьма полезной теорией физической адсорбции.