
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислотно-основной характер оксидов хрома (II), (III), способы получения и свойства. Соли хрома (III), получение и свойства; квасцы, хромиты, получение, свойства.
|
|
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):

Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+) до зелёного (в координационной сфереприсутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):

Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:


Сплавляя Cr2O3 со щелочами, получают хромиты:
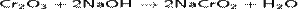
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:

При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):

То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):

Сульфат хрома(III)-калия — неорганическое соединение, соль металлов калия и хрома и серной кислоты с формулой KCr(SO4)2, красные кристаллы, растворимые в воде, образует кристаллогидраты — хромокалиевые квасцы.
Получение.
· Образуется при выпаривании растворов сульфатов хрома и калия:
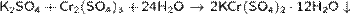
· Восстановление бихромата калия в кислой среде:


Химические свойства.
· Безводную соль получают сушкой кристаллогидрата при нагревании:

· Разлагается при нагревании:

· В горячей воде подвергается медленному гидролизу:
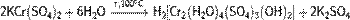
· Разлагается разбавленными щелочами:

· и концентрированными:

· Восстанавливается атомарным водородом:

· Окисляется концентрированной перекисью водорода в щелочной среде:
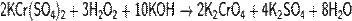
Хромитами с общей формулой RCrO2 называются соли хромистой кислоты HCrO2.
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
Хромиты обладают различной окраской - от темно коричневой до совершенно черной и обычно встречаются в виде сплошных массивов. Хромит мягче многих других минералов, температура плавления хромита зависит от его состава 1545-1730 0С.
Хромит имеет металлический блеск и почти нерастворим в кислотах.