
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Триоксид хрома, его свойства, хромовые кислоты; хроматы и дихроматы; их взаимные переходы, получение и свойства.
|
|
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть с увеличением кислотности:
2CrO 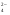
 +2H→ Cr2O
+2H→ Cr2O 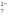 +H2O
+H2O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, то окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
Cr2O+2OH→ 2CrO+HO
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
H2CrnO3n+1→ H2O+nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария, как к растворам хроматов, так и к растворам дихроматов:
Ba+CrO→ BaCrO↓
2Ba+CrO+H2O→ 2BaCrO↓ +2H
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Хроматы — соли хромовой кислоты H2CrO4. Устойчивы в нейтральной и щелочной среде, в кислой среде обратимо переходят в дихроматы — соли дихромовой кислоты H2Cr2O7.
Хроматы получают путём сплавления CrO3 с основными оксидами:
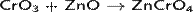
Более распространено окисление соединений Cr3+ в щелочных растворах:
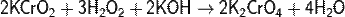
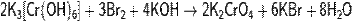
При этом происходит переход зелёной окраски раствора (ион Cr3+) в жёлтую (ион CrO42− ).
Химические свойства.
Хромат-ион при подкислении переходит в дихромат-ион (при этом окраска раствора становится оранжевой), в растворах существует равновесие между хромат- и дихромат-ионами:

Хроматы устойчивы в нейтральной и щелочной среде, а дихроматы — в кислой.
Большинство дихроматов имеет оранжево-красную окраску. Растворимость их, как правило, выше, чем соответствующих хроматов. Почти все дихроматы щелочных, щелочноземельных и тяжёлых металлов хорошо растворимы в воде, малорастворимы дихроматы таллия и серебра.
Дихроматы, как и хроматы, в кислой среде являются сильными окислителями за счёт восстановления Cr(VI) до Cr(III), например:
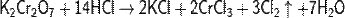
При нагревании дихроматы малоустойчивы:
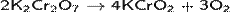
61. Соединения молибдена и вольфрама – оксиды и гидроксиды; вольфраматы и молибдаты, способы получения и свойства; изополи- и гетерополикислоты и их соли. Применение простых веществ и соединений.
Оксид вольфрама(IV) — неорганическое соединение, окисел металла вольфрама с формулой WO2, коричневые кристаллы, не растворимые в воде.
Получение.
· Восстановление оксида вольфрама(VI) водородом:

· Восстановление оксида вольфрама(VI) металлическим вольфрамом:
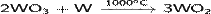
· Восстановление оксида вольфрама(VI) углеродом:

Химические свойства.
· Окисляется при нагревании на воздухе:
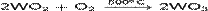
· Реагирует при нагревании с концентрированными кислотами:
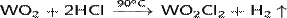
· Реагирует при нагревании с концентрированными щелочами:

Не растворяется в воде.
Оксид вольфрама(VI) (триоксид вольфрама или вольфрамовый ангидрид) WO3 — химическое соединение, содержащее кислород и переходный металл вольфрам. Обладает кислотными свойствами.
Свойства.
Порошок лимонно-жёлтого цвета. В воде и минеральных кислотах (за исключением фтороводородной кислоты) практически не растворяется. До металла восстанавливается водородом при температуре 700—900 °C, углеродом — при температуре 1000 °C.
Получение.
Триоксид вольфрама получают термическим разложением гидрата WO3•H2O (вольфрамовой кислоты) или паравольфрамата аммония(NH4)10[H2W12O42]•4H2O при температуре 500—800 °C.
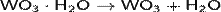
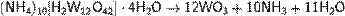
Другой способ получения: окисление металлического вольфрама в атмосфере кислорода при температуре выше 500 °C[1].
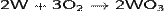
Существуют несколько гидроксидов, включая вольфрамовую кислоту (H2WO4) (желтый гидрат), из которой получают нормальные вольфраматы.
Получение.
Получается при действии сильных кислот на растворы вольфраматов щелочных металлов. Вольфрам в смеси азотной и плавиковой кислот растворяется, образуя вольфрамовую кислоту. Триоксид вольфрама не растворяется в воде. Получить вольфрамовую кислоту можно следующим образом:

Так же она получается при действии карбоната водорода и вольфрамата натрия:

ВОЛЬФРАМАТЫ, соли вольфрамовых кислот (напр., Н2WO4). Na2WO4 используют в производстве пигментов. CaWO4, BaWO4 и MgWO4 - люминофоры. Вольфраматы редкоземельных элементов - компоненты лазерных материалов.
Оксид молибдена(III) — неорганическое соединение, оксид металла молибдена с формулой Mo2O3, чёрные кристаллы, не растворимые в воде.
Получение.
· Разложение гидроксида молибдена(III) при нагревании:

· Восстановление калием оксида молибдена(VI), растворенного в жидком аммиаке:
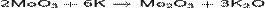
· Осторожное восстановление оксида молибдена(VI) водородом:
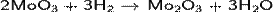
Оксид молибдена(III) образует чёрные кристаллы.
Не растворяется в воде.
Гидроксид молибдена(III) — неорганическое соединение, гидроокись молибдена с формулой Mo(OH)3, чёрный порошок, не растворяется в воде.
Получают осаждением щелочами солей молибдена(III):

Гидроксид молибдена(III) образует чёрный порошок, не растворяется в воде.
Разлагается при нагревании:
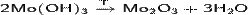
Реагирует с щелочными водными растворами с выделением водорода:

Оксид молибдена(IV) — неорганическое соединение, оксид металла молибдена с формулой MoO2, коричнево-фиолетовые кристаллы, не растворимые в воде.
Получение.
· Действие перегретого водяного пара на металлический молибден:
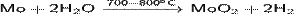
· Действие на молибден диоксида углерода:
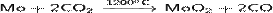
· Восстановление водородом оксида молибдена(VI):
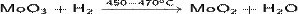
· Гидролиз перегретым водяным паром сульфида молибдена(IV):
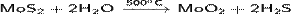
· Разложение холодной концентрированной серной кислотой сульфида молибдена(IV):
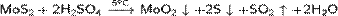
Химические свойства.
· Разлагается при нагревании:
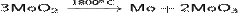
· Реагирует с горячей концентрированной азотной кислотой:
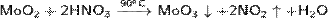
· С щелочами образует молибдаты(IV):

· Восстанавливается водородом:
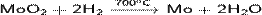
· Реагирует с хлором:
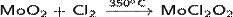
Оксид молибдена(V) — неорганическое соединение, окисел металла молибдена с формулой Mo2O5, тёмно-фиолетовые кристаллы, не растворимые в воде.
Получение.
· Разложение гидроксида молибдена(V):
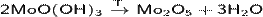
· Разложение оксосолей молибдена:
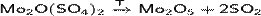

Оксид молибдена(V) образует тёмно-фиолетовые кристаллы, не растворяется в воде.
Гидроксид молибдена(V) — неорганическое соединение, оксид-гидроксид молибдена с формулой MoO(OH)3, бурый порошок, не растворяется в воде.
Получение.
· Дегидратация свежеполученного Mo(OH)5 (растворение соединений молибдена(V) в растворе аммиака):
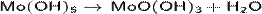
· Растворение в щелочных водных растворах гидроксида молибдена(III):
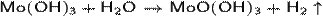
Химические свойства.
· Разлагается при нагревании в инертной атмосфере:

· Окисляется при нагревании на воздухе:
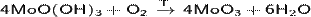
Оксид молибдена(VI) 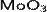 (триоксид молибдена, триоксомолибден, молибдит) — бинарное неорганическое химическое соединение кислорода с молибденом.
(триоксид молибдена, триоксомолибден, молибдит) — бинарное неорганическое химическое соединение кислорода с молибденом.
Реагирует с кислотами, щелочами, раствором аммиака и сульфида натрия[1]. Растворяется в воде, в избытке растворов щелочей или карбонатов щелочных металлов. Триоксид молибдена производится промышленным методом обжига дисульфида молибдена — главной руды молибдена:
2MoS2 + 7O2 → 2MoO3 + 4SO2
Получается прокаливанием молибдена на воздухе при высокой температуре:
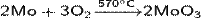
Лабораторный синтез предполагает подкисление водного раствора молибдата натрия с хлорной кислотой[4]. При этом получаются диаква-триоксид молибдена и перхлорат натрия:
Na2MoO4 + 2HClO4 + H2O → MoO3(H2O)2 + 2NaClO4
Диаква-триоксид молибдена легко теряет воду, давая моногидрат. Оба ярко-желтого цвета.
Молибденовый ангидрид растворяется в воде давая «молибденовую кислоту» (MoO3 · (2) H2O).
Молибдаты, соли молибденовых кислот. Известны нормальные молибдаты — соли молибденовой кислоты Н₂ МоО₄ и полимолибдаты — соли изополимолибденовых кислот. Все нормальные молибдаты, за исключением молибдатов щелочных металлов и магния, малорастворимы в воде.
Основное количество молибдена и вольфрама применяется в производстве легированных сталей. Молибденсодержащие стали используются для изготовления инструментов, валов турбин, броневых плит, стволов огнестрельного оружия. Вольфрамсодержащие стали характеризуются прочностью на истирание, устойчивостью к высоким температурам и химическим реагентам, пластичностью и упругостью.
62. Марганец, рений – общая характеристика, получение, свойства. Применение марганца, рения и их соединений.
Ма́ рганец Mn — элемент побочной подгруппы седьмой группы четвёртого периодапериодической системы химических элементов Д. И. Менделеева с атомным номером 25. Марганец — металл серебристо-белого цвета. Относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Получение.
· Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
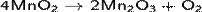

· Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (~80 % Mn).
· Чистый металлический марганец получают электролизом.
Химические свойства.
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
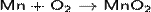
Марганец при нагревании разлагает воду, вытесняя водород:

При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
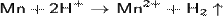
С концентрированной серной кислотой реакция идёт по уравнению:
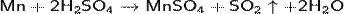
С разбавленной азотной кислотой реакция идёт по уравнению:
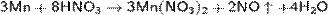
В щелочном растворе марганец устойчив.
Основное количество марганца (чаще в виде сплава с железом - ферромарганца) применяется для раскисления чугуна и сталей. Стали с большим содержанием марганца (10-15 %) имеют большое сопротивление к удару и истиранию. Диоксид марганца применяется как катализатор и окислитель, KMnO4 применяется как окислитель и антисептик.
Марганец - биологически важный элемент, играет значительную роль в обмене веществ, влияет на процессы роста и размножения, а также кровообразования. Ускоряет образование антител, нейтрализует чужеродные белки. Внутривенным введением раствора MnSO4 удается спасти укушенных каракуртом. Важен марганец и для растений - ускоряет образование хлорофилла и витамина С. Повышает урожайность некоторых сельскохозяйственных культур, например, пшеницы и хлопчатника.
Ре́ ний — химический элемент с атомным номером 75 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом Re. При стандартных условиях представляет собой плотный серебристо-белый переходный металл.
Получение.
Рений получают при переработке сырья с очень низким содержанием целевого компонента (в основном это медное и молибденовое сульфидное сырьё).
Переработка сульфидного рений содержащего медного и молибденового сырья основана на пирометаллургических процессах (плавка, конвертирование, окислительный обжиг). В условиях высоких температур рений возгоняется в виде высшего оксида Re2O7, который затем задерживается в системах пылегазоулавливания.
В случае неполной возгонки рения при обжиге молибденитовых концентратов часть его остаётся в огарке и затем переходит в аммиачные или содовые растворы выщелачивания огарков (NH4ReO4), которые позже восстанавливают водородом:
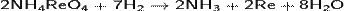
Полученный порошок рения методами порошковой металлургии превращают в слитки металла.
Таким образом, источниками получения рения при переработке молибденитовых концентратов могут служить сернокислотные растворы мокрых систем пылеулавливания и маточные растворы после гидрометаллургической переработки огарков.
При плавке медных концентратов с газами уносится 56—60 % рения. Невозогнавшийся рений целиком переходит в штейн. При конвертировании последнего содержащийся в нём рений удаляется с газами. Если печные и конверторные газы используют для производства серной кислоты, то рений концентрируется в промывной циркуляционной серной кислоте электрофильтров в виде рениевой кислоты. Таким образом, промывная серная кислота служит основным источником получения рения при переработке медных концентратов.
Основные методы выделения из растворов и очистки рения — экстракционные и сорбционные.
После возгонки и очистки раствора итоговый выход из руды составляет 65—85 %. Ввиду столь низкой доли выделения дорогого металла ведутся поиски альтернативных способов извлечения из руды (что применимо ко всем рассеянным металлам). Одним из современных методов является извлечение нанофракций в водный, а не кислотный или щелочной раствор. Таким образом снижается предел обнаружения ряда химических элементов на 2—3 порядка, то есть можно фиксировать значительно меньшие концентрации.
Химические свойства.
Компактный рений устойчив на воздухе при обычных температурах. При температурах выше 300 °C наблюдается окисление металла, интенсивно окисление идёт при температурах выше 600 °C. Рений более устойчив к окислению, чем вольфрам, не реагирует непосредственно с азотом и водородом; порошок рения лишь адсорбирует водород. При нагревании рений взаимодействует с фтором, хлором и бромом. Рений почти не растворим в соляной и плавиковой кислотах и лишь слабо реагирует с серной кислотой даже при нагревании, но легко растворяется в азотной кислоте. С ртутью рений образует амальгаму.
Рений взаимодействует с водными растворами пероксида водорода с образованием рениевой кислоты. Рений — единственный из тугоплавких металлов не образует карбидов.
Рений используют в качестве добавки к сплавам и для изготовления электродов в рентгеновских трубках и радиолампах. Осаждением металлического рения получают зеркала с высокой отражательной способностью. Рений и его соединения применяют как катализаторы.