
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные термодинамические понятия и определения
|
|
ЛЕКЦИЯ 1
Задачи и разделы физической химии. Основные термодинамические понятия и определения. Первый закон термодинамики. Работа расширения при различных процессах. Энтальпия. Закон Гесса. Стандартные теплоты образования и теплоты сгорания веществ. Теплоемкость. Уравнение Кирхгофа.
ЗАДАЧИ И РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИ
Физическая химия – раздел химии, в котором изучается взаимосвязь химических процессов и физических явлений, которые их сопровождают, устанавливается связь между химическим составом, строением веществ и их свойствами, исследуются механизм и скорость химических реакций в зависимости от условий их протекания.
Содержание курса физической химии обычно делят на несколько основных разделов, характеризующих направление этой науки и определяющих ее предмет. Рассмотрим основные ее разделы:
— химическая термодинамика – изучает связь между теплотой и работой, и свойствами веществ или систем. Изучает макроскопические свойства тел и их изменения при обмене тел или систем энергией или веществом. Изучает свойства систем независимо от пространства и времени, ее не интересует скорость, и путь протекания химических реакций. В свою очередь химическая термодинамика включает термохимию, в которой изучаются тепловые эффекты химических реакций.
— учение о растворах – рассматривает природу растворов, их внутреннюю структуру и важнейшие свойства.
— электрохимия – изучает особенности свойств растворов электролитов, электропроводность растворов, процессы электролиза, работу гальванических элементов и электрохимическую коррозию металлов.
— химическая кинетика – изучает скорость и молекулярный механизм химических реакций, как в гомогенной, так и в гетерогенной среде, включая и явления катализа.
— коллоидная химия — наука, изучающая свойства гетерогенных высокодисперсных систем и протекающих в них процессов.
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Система – тело или группа тел, реально или мысленно выделенных из окружающей среды.
Термодинамическая система – группа взаимодействующих тел системы, между которыми происходит обмен теплотой или веществом, либо она описывается термодинамическими параметрами.
Окружающая среда – всё, что находится в контакте с системой.
В химической термодинамике выделяют несколько типов систем по их способности взаимодействовать с внешней средой:
— открытая – система, обменивающаяся с окружающей средой веществом и энергией;
— закрытая – система, обменивающаяся с окружающей средой только энергией и работой, но не веществом;
— изолированная – система не обменивается с окружающей средой ни веществом, ни энергией.
Состояние системы – совокупность всех физических и химических свойств системы.
Термодинамические параметры состояния системы – измеримые свойства системы, связанные с энергией и характеризующие её состояние. Различают:
1. Экстенсивные свойства, зависящие от массы системы (V, m, U, H и т. д.) и обладающие свойством аддитивности:
свойство системы = S свойств частей.
2. Интенсивные свойства, не зависящие от массы системы (T, p, m, r и т. д.). Эти свойства не суммируются, а выравниваются.
Основные параметры состояния – параметры, поддающиеся прямому измерению. Те параметры, которые нельзя измерить непосредственно, рассматривают как функции основных параметров состояния.
Функция состояния – изменение её определяется только исходным и конечным состоянием системы и не зависит от путей перехода.
Изменение состояния системы, характеризующееся изменением её термодинамических параметров, называется термодинамическим процессом.
Изменение состояния системы может происходить при различных условиях, поэтому различают:
1). Равновесные и неравновесные процессы. Равновесные процессы рассматриваются как непрерывный ряд равновесных состояний системы. Равновесное состояние системы – состояние, не изменяющееся во времени и не требующее для своего поддержания каких-либо внешних факторов. Неравновесные — это процессы, после протекания которых систему нельзя вернуть в исходное состояние без того, чтобы в ней не осталось каких-либо изменений.
2). Обратимые и необратимые процессы. Обратимые – процессы, допускающие возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми.
3). Самопроизвольные и несамопроизвольные процессы. Самопроизвольные – процессы, происходящие сами собой (не требующие затраты энергии извне) и приближающие систему к равновесию. Несамопроизвольные – процессы, требующие затраты энергии извне.
Отметим некоторые частные виды процессов, с которыми в дальнейшем придётся иметь дело:
а) изотермический (T = const);
б) изобарный (p = const);
в) изохорный (V = const);
г) адиабатический (нет обмена теплотой между системой и окружающей средой);
д) изобарно – изотермический (p = const, T = const);
е) изохорно – изотермический (V = const, T = const).
Рассмотрим ещё некоторые понятия.
Энергия – мера способности системы совершать работу.
Внутренняя энергия – весь запас внутренней кинетической и потенциальной энергии вещества без кинетической и потенциальной энергии всей системы. Внутренняя энергия обозначается символом U. Абсолютное значение внутренней энергии определить невозможно даже для простейших систем. Однако для целей термодинамики этого и не требуется. Важно количественно определить изменение внутренней энергии при переходе из одного состояния в другое:
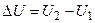 . (1.1)
. (1.1)
Величина внутренней энергии системы считается положительной, если в рассматриваемом процессе она увеличивается. В равновесном состоянии система обладает определённым запасом энергии, поэтому внутренняя энергия является функцией состояния.
Работа и теплота – две возможные формы передачи энергии от одной системы к другой. Работа – это энергия, передаваемая одним телом другому, не зависящая от температуры тел и не связанная с переносом массы.
Работа обозначается символом A, при этом работа положительна (А > 0), если она совершается системой против внешних сил, и отрицательна (А < 0), если она выполняется над системой. В химической термодинамике чаще всего рассматривают работу расширения. Если рассматривать работу расширения А, совершаемую системой, то равновесному процессу всегда соответствует максимальная работа.
Теплота – энергия, передаваемая одним телом другому, зависящая от температуры тел и не связанная с переносом массы. Теплота обозначается символом Q, при этом она положительна (Q > 0), если теплота поступает в систему (такой процесс называется эндотермическим), и отрицательна (Q < 0), если теплота отводится из системы (такой процесс называется экзотермическим).
В равновесном состоянии система не обладает ни запасом теплоты, ни запасом работы, поэтому они являются функциями процесса. Передача теплоты или совершение работы осуществляются лишь при взаимодействии системы с внешней средой или другой системой.