
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Термодинамические константы равновесия.
|
|
В случае реальных систем равновесные концентрации в выражении (4.5) заменяют на равновесные активности (а i) и получают термодинамическую константу химического равновесия:
 , (4.6)
, (4.6)
где n i – стехиометрические коэффициенты уравнения реакции. Величины  положительны для продуктов реакции и отрицательны для исходных веществ.
положительны для продуктов реакции и отрицательны для исходных веществ.
Константы химического равновесия, выраженные через равновесные парциальные давления р i или равновесные фугитивности f i участников реакции, имеют вид:
 , (4.7)
, (4.7)
 . (4.8)
. (4.8)
Приведенные выше равенства для констант равновесия выражают закон, который был сформулирован К. Гульдбергом и П. Вааге – закон действующих масс.
Отношение произведения равновесных парциальных давлений (концентраций) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к произведению равновесных парциальных давлений (концентраций) исходных веществ при данной температуре есть величина постоянная, называемая константой химического равновесия. Одним из важных выводов из закона действия масс заключается в установлении взаимосвязанности парциальных давлений (или концентраций) всех веществ, участвующих в реакции. В условиях равновесия парциальные давления (или концентрации) всех веществ, участвующих в реакции, связаны между собой. Нельзя изменить парциальное давление (или концентрации) ни одного из них, чтобы это не повлекло за собой такого изменения парциальных давлений (или концентраций) всех остальных веществ, участвующих в реакции, которое не привело бы к прежнему численному значению константы равновесия при данных условиях.
Найдем связь между К Р и К С для реакций между идеальными газами. Выразим равновесные парциальные давления с помощью уравнения Менделеева–Клапейрона:

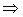
 . (4.9)
. (4.9)
Тогда, на основании уравнений (4.5) и (4.7), имеем
 , (4.10)
, (4.10)
где Dn – изменение числа молей газообразных веществ в ходе реакции.
3.2. ПРИНЦИП ЛЕ–ШАТЕЛЬЕ.
Как отмечалось ранее, химические равновесия являются динамичными и подвижными. При изменении внешних условий может происходить сдвиг равновесия в сторону образования либо продуктов реакции, либо исходных веществ. Впервые принцип смещения равновесия сформулировал А. Ле-Шателье.
Принцип Ле–Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в сторону того процесса, который уменьшает это воздействие.
Теоретически этот принцип был основан Ф. Брауном и теперь известен, как принцип Ле-Шателье – Брауна.
Математически этот принцип может быть представлен в виде:
 ,
,
 , (4.11)
, (4.11)
где  – константа равновесия, xi – обобщенная сила, yi – обобщенная сопряженная данной силе xi координата. Неравенство (4.11) имеет следующий смысл: изменение обобщенной силы (интенсивный параметр) при постоянстве остальных сил смещает равновесие в таком направлении, при котором изменение сопряженной обобщенной координаты препятствует изменению обобщенной силы. Если рассматривают влияние температуры (обобщенной силы) при постоянстве других интенсивных параметров на химическое равновесие, то в качестве сопряженной координаты используют тепловой эффект реакции. Чем больше по величине тепловой эффект реакции, тем сильнее влияет на положение равновесия изменение температуры. При изменении давления – обобщенной силы – сопряженной обобщенной координатой будет изменение объёма в ходе реакции, взятое с обратным знаком.
– константа равновесия, xi – обобщенная сила, yi – обобщенная сопряженная данной силе xi координата. Неравенство (4.11) имеет следующий смысл: изменение обобщенной силы (интенсивный параметр) при постоянстве остальных сил смещает равновесие в таком направлении, при котором изменение сопряженной обобщенной координаты препятствует изменению обобщенной силы. Если рассматривают влияние температуры (обобщенной силы) при постоянстве других интенсивных параметров на химическое равновесие, то в качестве сопряженной координаты используют тепловой эффект реакции. Чем больше по величине тепловой эффект реакции, тем сильнее влияет на положение равновесия изменение температуры. При изменении давления – обобщенной силы – сопряженной обобщенной координатой будет изменение объёма в ходе реакции, взятое с обратным знаком.
Итак, повышение (или понижение) температуры системы смещает равновесие в том направлении (прямом или обратном), в котором поглощается (или выделяется) теплота. Повышение давления смещает равновесие в направлении уменьшения объёма системы.
Пример 3.2. Рассмотрим реакцию
 (
( )
)
1. Увеличим температуру: так как реакция экзотермическая, т. е. идёт с выделением тепла, равновеие смещается в сторону исходных веществ (обратная реакция идёт с поглощением тепла).
2. Увеличим давление: так как прямая реакция идёт с уменьшением числа молей газобразных веществ (т.е. объем уменьшается), то равновесие смещается в сторону продуктов реакции.