
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изотерма химической реакции.
|
|
Уравнение изотермы (или просто изотерма) химической реакции позволяет связать возможное направление химической реакции с исходным составом реагирующих веществ. При исследовании химических процессов чаще пользуются величиной D G, которая является индикатором реакционной способности веществ в процессах при Т, р = const.
Изменение энергии Гиббса в ходе протекания химической реакции между газообразными веществами равно
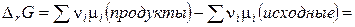
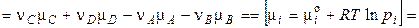
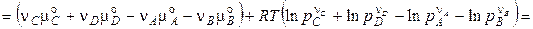
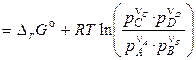 . (4.12)
. (4.12)
При наступлении равновесия в системе 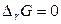 , тогда
, тогда
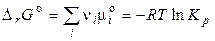 , (4.13)
, (4.13)
где  — стандартное изменение энергии Гиббса химической реакции (когда все вещества находятся в стандартных условиях).
— стандартное изменение энергии Гиббса химической реакции (когда все вещества находятся в стандартных условиях).
Значит,
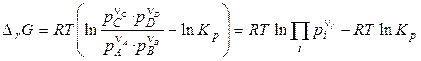 , (4.14)
, (4.14)
 , (4.15)
, (4.15)
где p i — начальные (заданные) парциальные давления участников реакции.
Последние уравнения называют уравнениями изотермы химической реакции или уравнениями Вант–Гоффа. Они выражают зависимость Dr G от состава системы, т. е. зависимость между термодинамическим потенциалом реакции Dr G, константой химического равновесия (Кp) и условиями проведения реакции.
По уравнению изотермы химической реакции можно рассчитать изменение энергии Гиббса при соответствующих условиях, т.е. определить возможность, направление и предел протекания самопроизвольного процесса. Чтобы самопроизвольно осуществлялась прямая реакция, изменение энергии Гиббса (Dr G) должно быть отрицательным, а это возможно при условии:
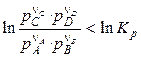 . (4.16)
. (4.16)
Если
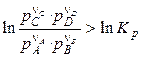 , (4.17)
, (4.17)
то самопроизвольно пойдет обратная реакция.
При установлении равновесия:
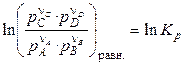 , (4.18)
, (4.18)
где p i — равновесные парциальные давления участников реакции.
Аналогичным способом получают выражение для изменения энергии Гельмгольца для процессов, протекающих при T, V = const:
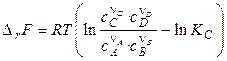 . (4.19)
. (4.19)