
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 10. Хiмiчний склад і властивості пiдземних вод
|
|
В підземних водах в розчиненому стані найбiльш поширеними в водi є Сl, S, C, Si, N, O, H, K, Na, Mg, Ca, Fe, Al. В них також завжди присутнiй водневий йон [H]+i гiдроксидний йон [OH]-. Добуток концентрацiй йонiв водню i гiдроксиду є величиною постiйною i складає [H]+Ч [OH]-=10-14. Це значить, що в 1 л чистої води при температурi 18°С мiстяться 10-7грам-йонiв гідрогену i 10-7грам-йонiв гiдроксиду. Концентрацiєю у воді йона гідрогену визначається кислотнiсть або лужнiсть розчинiв, котрі характеризуються показником рН.
[H]+=10-7, тобто lg[H]+=-7 i -lg[H]+=7.
Вираз -lg[H]+позначають через рН (показник гідрогену). В водах з нейтральною реакцiєю рН дорiвнює 7, якщо рН менше 7 - реакцiя води вважається кислою, а якщо бiльше 7 - лужною.
Інші йони впливають на властивостi пiдземних вод так.:
Натрій (Na+) поширений в сполуках переважно з хлором, рiдше з SO42-i ще рiдше з HCO3-. В посушливих районах капiлярне пiдняття ґрунтових вод, вмiщуючих солi натрiю, зумовлює утворення солончакiв.
Калій (К+) приймає участь в утвореннi вторинних нерозчинних у водi мiнералiв i добре поглинається рослиннiстю.
Кальцій (Са2+) в пiдземних водах зустрiчається дуже часто, але кiлькiсть його менша від вмiсту натрiю. Солi кальцiю зумовлюють твердiсть води.
Магній (Мg2+) поширений в підземних водах менше, нiж кальцiй. Солi магнiю також зумовлюють твердiсть води.
Залізо (Fe2+) присутнє у водi переважно у закиснiй формi, окиснiй, а також у виглядi колоїдiв. Закиснi форми нестiйкi i при доступi кисню легко окислюються. Сполуки залiза надають водi неприємного смаку i часто роблять її непридатною до вживання. Випадаючi в осад, пластiвцi сполук залiза можуть виводити з ладу дренажнi меліоративні системи.
Хлор (Cl-) в пiдземних водах дуже поширений i знаходиться в них як продукт розчинення хлоридів натрю, кальцiю i магнiю. Він потрапляє в підземні води з покладів камiнної cолi i з населених пунктів. Води, надмірно збагачені хлором, можуть бути непридатнi для пиття.
Сульфат-йон (SO42-) утворюється в пiдземних водах при окисненнi сульфiдiв, наприклад, пiриту. Ciрчана кислота, що утворюється при цьому, зразу ж вступає в реакцiю з оточуючими породами i, перш за все, з кальцитом, утворюючи гiпс. Сульфатні води згубно діють на рослини.
Сполуки карбону присутні у водi як продукти розчинення карбонатної кислоти: (CO2), (HCO3-), (CO32-). Концентрацiя вiльної кислоти визначає агресивнiсть пiдземних вод i тому на її вмiст завжди потрiбно звертати особливу увагу.
При проведеннi хiмiчного аналiзу пiдземних вод окрiм визначення рН визначають масу сухого залишку (пiсля випарювання) i кiлькостi речовин, що мiстяться у водi. При концентрацiї всiх солей до 1 г/л воду називають прiсною, при 1-10 г/л - солонуватою, вiд 10 до 50 г/л - солоною i при концентрацiї понад 50 г/л - розсолом (ропою).
Кiлькостi речовин, розчинених в підземних водах, визначають в мiлiграмах на 1 л води та перераховують в еквiвалентну форму. Якщо атомну (iонну) масу будь-якого iона роздiлити на його валентнiсть, отримаємо еквiвалентну масу. Частка вiд дiлення одиницi на еквiвалентну масу дає величину перерахункового коефiцiєнта. Так, наприклад, атомна маса кальцiю 40, 07, валентнiсть - 2, значить, еквiвалентна маса дорiвнює 40, 07: 2=20, 035 i перерхунковий коефiцiєнт складе 1: 20, 035=0, 0499. Для сульфат-iону (SO2-) iонна маса дорiвнює 32, 07+16*4=96, 07, валентнiсть - 2, еквiвлентна маса - 96, 07: 2=48, 035 i перерахунковий коефіцієнт -1: 48, 035=0, 0208. Величини перерахункових коефiцiєнтiв для всiх iонiв наводяться в готовому видi в спецiальнiй лiтературi.
Перерахунок аналiзiв iз iонної форми в мiлiграм-еквiвалентну і далi в процент-мiлiграм-еквiвалентну форми ведуть у виглядi табл. 9. Для вираження вмiсту iонiв в мiлiграм-еквiвалентнiй формi, потрiбно вмiст кожного iона в мг/л помножити на його перерахунковий коефiцiєнт, наприклад для iона НСО32-: 353*0, 0164=5, 79.
Кiлькостi речовин виражають в iоннiй формi, при якiй вмiст окремих iонiв визначають в мiлiграмах на 1 л води. Однак, результати хiмiчного аналiзу, вираженi в iоннiй формi, незручнi для порiвняння. Тому, для того, щоб мати можливiсть спiвставляти аналiзи води, останнi перераховують в еквiвалентну форму. Якщо результати аналiзу вираженi в мiлiграм-еквiвалентнiй формi, то перед символом iона ставлять букву r, наприклад r Cl=4.74.
При визначеннi процент-мiлiграм-еквiвалентного вмiсту кожного iона поступають таким чином. Суму анiонiв в мiлiграм-еквiвалентах (13, 15) приймають за 100%, а вмiст кожного iона приймають за x.
Таблиця. 9.
Перерахунок аналiзу води з iонної в процент-мiлiграм-еквiвалентну форму
| Iон | Вмiст в мг/л | Перерахунковий коефiцiєнт | Мiлiграм-еквiвалент | Процент-мiлiграм-еквiвалент |
| Анiони: НСО3- SO42- Cl- Разом: Катiони: Na+ Ca2+ Mg2+ Разом: Усього: | 0, 0164 0, 0208 0, 0282 - 0, 0435 0, 0499 0, 0822 - - | 5, 79 2, 62 4, 74 13, 15 10, 74 0, 40 2, 14 13, 28 26, 43 | 44, 04 19, 92 36, 04 100, 00 80, 87 3, 01 16, 12 100, 00 200, 00 |
Кiлькiсть розчинених у водi вуглекислих i сiрчанокислих солей кальцiю та магнiю зумовлює т в е р д і с т ь води. За одиницю твердостi приймають 1 мг-екв кальцiю, тобто 20, 04 мг кальцiю на 1 л води або 1 мг-екв магнiю (12, 16 мг/л). За твердiстю води подiляються на: дуже м'якi (до 1.5 мг-екв/л), м'якi (1.5-3.0 мг-екв/л), середньої твердостi (3.0-6.0), досить твердi (6.0-9.0) i дуже твердi - понад 9.0 мг-екв/л. Тверда вода погано змилюється, утворює накип в посудi, в нiй довше варяться продукти.
Класифiкацiя пiдземних вод за хімічним складом (мал.25) грунтується на видiленнi класiв за переважаючим анiоном, груп - за переважаючим катiоном i типiв вод - за спiввiдношенням мiж йонами. Видiляють чотири типи природних вод: перший тип - НСО3-> Са2++ Mg2+- води лужнi, мякi; другий тип – HCO3-< Ca2+ + Mg2+ < HCO3- + SO42-- води малої та помiрної мiнералiзацiї; третiй тип - HCO3- + SO42- < Ca2+ + Mg2-- води як правило високомiнералiзованi; четвертий тип – HCO3-= 0 - води кислi.

Мал. 25. Графічне зображення класифікації підземних вод за хімічним складом.
Серед рiзних способiв зображення складу пiдземних вод часто застосовуються формула М. Г. Курлова, квадрат Н. I. Толстихiна i графiки-трикутники. Курлов запропонував зображати аналiз у виглядi п с е в д о д р о б у. Перед дробом пишуть лiтеру М з iндексом, що дорiвнює кiлькостi сухого залишку в г/л. В чисельнику дробу виписують в спадному порядку анiони з iндексами, якi дорiвнюють вмiстам даних iонiв в водi в %-мг-екв, а в знаменнику - в тому ж порядку катiони. При цьому, iони, що мiстяться в кiлькостi до 10 %-мг-екв, не враховуються. Пiсля дробу вказують темпе-ратуру води (Т, °С) i витрату свердловини (джерела) (Q, м3/добу). Iнколи перед лiтерою М вказують газовий склад i наявнiсть специфiчних елементiв, звичайно не характерних для даної води (Fe, Al, Cu, Co, Ni, Mn, Mo, Br, тощо).
Попробуємо виразити розглянутий нами аналiз у виглядi формули Курлова. Через неповноту даних умовно приймемо температуру води рiвною 10°С, дебiт джерела - 200 м3/добу. Величину сухого залишку можна визначити з рiвняння:
M»1, 1(0, 5*HCO3-+SO42-+Cl-+Na++K++Ca2++Mg2+)»
1, 1(0, 5*353+126+168+247+0+8+26)»827мг/л. (20)
В цiй формулi пiдсумовують вмiсти всiх iонiв в мг/л i половину вмiсту НСО3-. Сума вмiсту iонiв перемножується на 1, 1. Запишемо тепер розглянутий нами приклад аналiзу у виглядi псевдодробу:
HCO344Cl36SO420
Приклад формули М.Г.Курлова: M 0, 8 ------------------------ T °10 Q 200. (21) Na81Mg16
Толстихiн запропонував зображувати аналiзи води точками на к в а д р а т і. Для цього беруть великий квадрат (мал. 26) i розбивають його на 100 маленьких, кожен з яких має свiй порядковий номер.
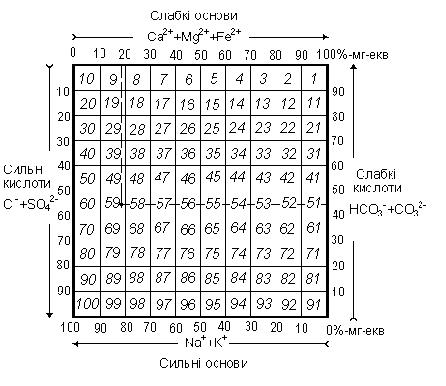
Мал. 26. Квадрат Толстихіна для графічного зображення хімічного складу підзетних вод.
По горизонтальних сторонах квадрата вiдкладають (в напрямках стрiлок) вмiст катiонiв, а по вертикалi - анiонiв. В на-шому прикладi Ca2++ Mg2+= 19, 13; HCO3-+CO32-= 44, 04. На перетинi вертикальної i горизонтальної лiнiй знаходимо, що вода вiдповiдає номеру 59.
Г р а ф і к и - т р и к у т н и к и (мал. 27) будують окремо для анi-онiв i катiонiв. На сторонах трикутникiв вiдкладають вмiсти певних iонiв (в %-мг-екв) i проводять лiнiї, паралельнi до сторiн малих трикутникiв, що вiдсiкають води даного типу вiд змiшаних. В кожному трикутнику наперетинi трьох лiнiй (за трьома iонами) утворюється точка, положення якої вказує на тип води. Розглянутий нами аналiз за анiонами попав у змiшанi води, а за катiонами - в натрiєвi.

Мал. 27. Графіки-трикутники для графічного зображеня хімічного складу підземних вод.
Кiлькiсть розчинених у водi вуглекислих i сiрчано-кислих солей кальцiю та магнiю зумовлює т в е р д і с т ь води. Iснують три системи твердостi: нiмецька, французька i англiйська. Для переводу iз однiєi системи градусiв в iншу iснують залежностi: 1° нім. = 1, 79° фр.= 1, 25° англ. В Українi замiсть твердостi в градусах введено поняття твердостi в мг-екв/л (1 мг-екв/л = 2, 8° нім.). За одиницю твердостi приймають 1 мг-екв кальцiю, тобто 20, 04 мг кальцiю на 1 л води або 1 мг-екв магнiю (12, 16 мг/л).
Тверда вода погано змилюється, утворює накип в посудi, в нiй довше варяться продукти.
Розрiзняють загальну, тимчасову i постiйну твердiсть води. Загальною називається твердiсть, що вiдповiдає пробi свiжої (сирої) води. При кип'ятiннi з води випадають у виглядi осаду (накипу) розчиненi в нiй солi кальцiю i магнiю. Твердiсть, визначена пiсля кип'ятiння, називається постiйною. Рiзниця мiж загальною i постiйною називається тимчасовою твердiстю.
О. А. Альокiн пропонує за твердiстю води подiляти на: дуже м'якi (до 1.5 мг-екв/л), м'якi (1.5-3.0 мг-екв/л), середньої твердостi (3.0-6.0), досить твердi (6.0-9.0) i дуже твердi - понад 9.0 мг-екв/л.
При оцiнцi пiдземних вод для водопостачання необхiдно враховувати, окрiм хiмiзму, також б а к т е р і о л о г і ч н и й с к л а д i їхня р а д і о а к т и в н і с т ь.
Серед бактерiй розрiзняють нешкiдливi i патогеннi (хвороботворнi). Встановлено, що кiлькiсть бактерiй зменшується з заглибленням водоносних горизонтiв i на глибинi 5-10 м їх вже практично не буває.
Бактерiологiчне дослiдження вод полягає в визначеннi числа колонiй (кiлькiсний аналiз), здатних виростати на прийнятих поживних середовищах при температурi 22°С за 48 годин, i в якiсному аналiзi, тобто в виявленнi мiкроорганiзмiв, якi вказують на небезпечнi забруднення (кишковi палички тощо). Для встановлення санiтарної оцiнки води в кiлькiсному вiдношеннi прийнята наступна схема: якщо в 1 мл води мiститься до 10 колонiй мiкроорганiзмiв - вода надзвичайно чиста, вiд 10 до 100 - дуже чиста, вiд 100 до 1000 - чиста, вiд 1000 до 10 000 - посередня, вiд 10 000 до 100 000 - нечиста i якщо мiститься понад 100 000 колонiй - вода дуже нечиста.
За вмiстом кишкової палички запропонований такий подiл за кiлькiстю вмiсту її в
1 л води: бездоганно здорова (менше 2), пiдозрiла (3-5), нездорова (6-20) i цiлком непридатна (понад 20).
Пiдземнi води, котрі вміщують природнi iзотопи урану, радону i радiю, називаються р а д іо а к т и в н и м и. Одиницею вимiрювання урану i радiю в водах служить грам на лiтр. Кiлькiсть радону виражається одиницею кюрi, тобто кiлькiстю радону, що знаходиться в радiоактивнiй рiвновазi з 1 г радiю. Меншими одиницями є мiлiкюрi (1*10-3кюрi) i еман (1*10-6кюрi). В бальнеологiї застосовується одиниця Махе (Ме), в гiдрогеологiї - еман на 1 л води. Спiввiдношення мiж цими одиницями такi: 1 еман/л = 1*10-10кюрi/л = 0, 275 Ме; 1 Ме = 3, 64*10-10кюрi/л = 3, 64 еман/л. Критерiї радiоактивностi мiнеральних вод дуже рiзнi (вiд 3 до 275 Ме), для питтєвого лiкування допускається вмiст до 800 Ме.
Вода вважається придатною для водопостачання, якщо вона задовiльняє такi вимоги:
1) сухий залишок до 1000 мг/л;
2) загальна твердiсть до 7 мг/екв;
3) постiйна твердiсть до 5 мг/екв;
4) вмiст окремих розчинених речовин в мг/л: залiза - до 1, 0, свинцю - до 0, 1, миш'яку - до 0, 05, фтору - до 1, 5.
Питна вода повинна бути прозорою, безколiрною, приємною на смак i не мати запаху.
Руйнiвний вплив пiдземних вод на бетони i металевi конструкцiї називають а г р е с и в н і с т ю. На практицi розрiзняють декiлька видiв агресивностi.
Вилуговуюча агресивнiсть виникає при малому вмiстi в водi гiдрокарбонатної вуглекислоти (до 1, 4 мг/екв/л). В цих умовах вiдбувається вимивання з бетону вапна, що в ньому мicтиться. Загальнокислотна агресивнiсть зумовлена низьким показником гідрогену, через що посилюється руйнування бетону. Вуглекисла агресивнiсть виникає внаслiдок дiї вiльної вуглекислоти (CO2). При цьому утворюється бiгiдрокарбонат кальцiю, котрий здатний розчинятись i легко виноситься з бетону. Сульфатна агресивнiсть виникає при наявностi в водi пiдвищеного вмiсту сульфат-йону. В бетонi вiд-бувається кристалiзацiя гiпсу, який, збiльшуючись в об'ємi, сприяє руйнуванню бето-ну. Магнезiальна агресивнiсть веде до руйнування бетонiв, якщо вмiст йонiв магнiю складатиме понад 1000 мг/л. Киснева агресивнiсть зумовлюється наявнiстю в водi кисню i проявляється переважно у вiдношеннi до металевих конструкцiй, викликаючи їх корозiю.
Оцiнка агресивностi води проводиться у вiдповiдностi з " Iнструкцiєю з проектування. Ознаки i норми агресивностi води - середовища для залiзобетонних та бетонних конструкцiй".
Практична робота №5 на тему: «Перерахунок і зображення результатів аналізів хімічного складу мінеральних підземних вод»
Д а н о: Результати аналізів хімічного складу мінеральних підземних вод в іонній формі (вказані на етикетці тари вітчизняної мінеральної води, що продається).
З а в д а н н я: Виконати перерахунок результатів аналізів хімічного складу мінеральної води (однієї з вітчизняних марок) в процент-мiлiграм-еквiвалентну форму; визначити її твердість, клас, групу, тип; зобразити склад води за допомогою формули М.Г.Курлова, квадрата Н. I. Толстихiна i графiків-трикутників.
Питання для самоконтролю
1. Як поділяються підземні води за походженням?
2. Вкажіть види зв'язаної вологи.
2. Вкажіть види вільної води.
3. Вкажіть основні фізичні властивості підземних вод.
4. Якими катіонами характеризується хімічний склад підземних вод?
5. Якими аніонами характеризується хімічний склад підземних вод?
6. Як поділяються підземні води за солоністю?
7. Як поділяються підземні води за жорсткістю?
8. На які класи поділяються підземні води за хімічним складом?
9. На які групи поділяються підземні води за хімічним складом?
10. На яки види поділяються підземні води за хімічним складом?
11. Вкажіть засоби зображення хімічного складу підземних вод.
12. Які є види хімічної агресивності підземних вод?
13. Як називається здатність гірських порід пропускати через себе воду?
14. Як називаються підземні води першого від поверхні постійно діючого водоносного горизонту?
15. Яка правильна назва процесу хімічного розчинення гірських порід рухомими підземними водами?
16. Яка правильна назва процесу механічного вимивання пісків рухомими підземними водами?
17. Якими грунтами за водопроникливістю є супіски?.
18. Якими грунтами за водопроникливістю є суглинки і глини?
19. Яке поняття виступає показником водопроникності гірських порід?
20. Як називаються підземні води першого від поверхні постійно діючого водоносного горизонту?
21. Як називається водоносний горизонт між двома шарами водотривких порід?
22. Які умови залягання ґрунтових вод?
23. Що таке гідро ізогіпси?
24. Які умови залягання артезіанських вод?
25. Чим відрізняється зона аераціїгрунтових вод від зони насичення?
- .