
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Визначення масової концентрації оцтової кислоти в розчині
|
|
Сутність методу. Оцтова кислота взаємодіє з гідроксидом натрію за рівнянням:
СН3СООН + NаОН = СН3СООNа + НОН
Оцтова кислота – одноосновна. Тому молярна маса еквівалента оцтової кислоти дорівнює її молярній масі
М(СН3СООН)eq = М(СН3СООН) = 60 г/моль.
Оцтова кислота належить до слабких кислот (Кдис. = 1, 74·10-5). Коли титрують цю кислоту розчином лугу, то в точці еквівалентності утворюється сіль оцтової кислоти (СH3-СООNa). Внаслідок гідролізу цієї солі в точці еквівалентності середовище буде слабколужним (рН = 8, 87). Стрибок титрування буде знаходитись в межах рН = 7, 7 – 10, 0.
Методика визначення. Бюретку заповнюють атестованим розчином NаОН. Піпеткою Мора місткістю 10 мл переносять аліквоту оцтової кислоти в колбу для титрування, і додають одну краплю розчину фенолфталеїну і титрують розчином NаОН до появи блідо-рожевого забарвлення, стійкого на протязі 30 секунд. Титрування проводять не менше трьох разів. Отримані результати титрування записують у робочий журнал. Об'єми розчину гідроксиду натрію, що витрачають на титрування, повинні відрізнятися не більше ніж на 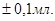 Розраховують середнє арифметичне значення об'єму (Vcеp) розчину гідроксиду натрію, що пішов на титрування.
Розраховують середнє арифметичне значення об'єму (Vcеp) розчину гідроксиду натрію, що пішов на титрування.
| № п/п | V(NaOH), мл | V(CH3COOH), мл |
Vcеp =
Обчислення. Масову концентрацію оцтової кислоти в розчині що аналізують розраховують за формулою:
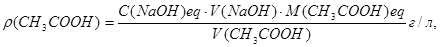
де С(NaОН)eq - молярна концентрація еквівалента гідроксиду натрію, моль/л;
V(NaOH) - середній об'єм атестованого розчину гідроксиду натрію, витрачений на титрування, мл;
V(CH3COOH) – об'єм аліквоти розчину СН3СООН, мл.
Далі розраховують відносну помилку визначення.