
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фіксування кінцевої точки титрування
|
|
Кислотно-основні реакції не супроводжуються яскравими зовнішніми ефектами, наприклад, зміною забарвлення розчину. Тому при титруванні для визначення точки еквівалентності застосовують спеціальні забарвлені сполуки, які називаються індикаторами. Індикатори являють собою слабкі органічні кислоти або основи, забарвлення яких залежить від рН розчину, причому зміна забарвлення відбувається при певних значеннях рН.
Слід відзначити, що практично неможливо підібрати індикатор, який би змінював своє забарвлення точно в точці еквівалентності даної реакції. Тому точку кінця титрування, яку визначають за допомогою індикатора, називають кінцевою точкою титрування. Кінцева точка титрування завжди відрізняється від точки еквівалентності. І чим більше різняться ці точки між собою, тим більшою буде похибка титрування.
Кислотно-основні індикатори бувають одно- і двокольорові.
Однокольорові індикатори мають забарвлення лише в одній, звичайно, іонній (сольовій) формі. Так, фенолфталеїн в недисоційованій формі – безбарвний, а в іонній – забарвлений в малиновий колір.
Двокольорові індикатори мають забарвлення як в молекулярній, так і в іонній формах. Забарвлення молекулярної і іонної форм двокольорових індикаторів різне і перехід від одного до другого відбувається при певному значенні рН.
Більшість кислотно-основних індикаторів – двокольорові.
Згідно іонно-хромофорній теорії індикаторів при дисоціації молекули індикатора відбувається зміна структури деяких груп атомів, які відповідають за забарвлення. Ці групи називають хромофорами (NO‾ ,

 -N=N-, ─).
-N=N-, ─).

 Перебудові хромофорів та підсиленню їх забарвлення сприяє присутність в молекулі деяких груп атомів, які називають ауксохромами (-OH, -NH2, -OCH3, -N(CH3)2, -N(C2H5)2 ).
Перебудові хромофорів та підсиленню їх забарвлення сприяє присутність в молекулі деяких груп атомів, які називають ауксохромами (-OH, -NH2, -OCH3, -N(CH3)2, -N(C2H5)2 ).
Рівновагу в розчині індикатора можна показати наступним рівнянням:
 HInd H+ + Ind‾ , звідки
HInd H+ + Ind‾ , звідки
молекулярна форма іонна форма
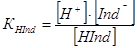 (1),
(1), 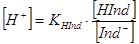 (2)
(2) 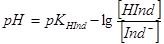 (3)
(3)
Для двокольорового індикатора (наприклад, метиловий червоний) молекулярна НInd і іонна Ind- форми мають різне забарвлення (червоне - жовте).
За рівнянням (3) можна обчислити межі рН, в яких змінюється забарвлення індикатора в розчині. При цьому треба мати на увазі, що людське око помічає зміну забарвлення розчину лише у тому випадку, коли концентрація однієї із форм індикатора складає не менше 10 % загальної їого кількості. Підставивши ці граничні концентрації в рівняння (3) одержимо:
Δ pН = рКHInd  ± 1
± 1
Цей інтервал називають інтервалом або зоною переходу забарвлення індикатора.
На положення і величину інтервалу переходу забарвлення індикатора  рН впливають всі ті фактори, від яких залежить константа дисоціації індикатора: іонна сила (μ), температура, сторонні речовини, природа розчинника. Певне значення має і кількість індикатора, який беруть при титруванні. При малій кількості індикатора зміна забарвлення розчину буде більш різкою, більш контрастною, ніж при великій концентрації індикатора. Тому при титруванні додають 1-2 краплі індикатора на 25 – 50 мл розчину.
рН впливають всі ті фактори, від яких залежить константа дисоціації індикатора: іонна сила (μ), температура, сторонні речовини, природа розчинника. Певне значення має і кількість індикатора, який беруть при титруванні. При малій кількості індикатора зміна забарвлення розчину буде більш різкою, більш контрастною, ніж при великій концентрації індикатора. Тому при титруванні додають 1-2 краплі індикатора на 25 – 50 мл розчину.
Вмежах інтервалу переходу індикатора є значення рН, при якому спостерігається найбільш помітна людським оком зміна кольору індикатора. Це значення рН називається показником титрування (рТ):
рТ = рКНIнd
При кислотно-основному титруванні індикатор вибирають таким чином:
1. щоб його показник титрування рТ співпадав з рН в точці еквівалентності;