
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способи титрування і розрахунки результатів титрування
|
|
В титриметричному аналізі найчастіше використовують розчини молярної концентрації еквівалентів. Оскільки цей спосіб вираження концентрації є універсальним.
Розрахунки результатів титрування будують на законі еквівалентів. Поняття еквівалентності реагуючих речовин в хімічних реакціях було і залишається одним із основних понять в хімії.
Добуток молярної концентрації еквівалента речовини С(В)eq на об’єм розчину Vр дорівнює кількості еквівалентів цієї речовини n(B)eq. Тому для реакції, в якій беруть участь рівні кількості еквівалентів речовин А та В
С(А)eq·Vр(А) = С(В)eq·Vр(В).
Тоді для визначення невідомої молярної концентрації еквівалента речовини (A) в розчині використовують формулу
С(А)eq = 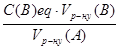 .
.
За результатами титрування обчислюють масу речовини [m(B)] в розчині за формулою
m(B)= 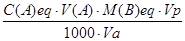 ,
,
де С(А)eq – молярна концентрація еквіваленту розчину, моль/л;
V(A) – об’єм розчину реагенту витрачений на титрування проби, мл;
М(В)eq – молярна маса еквіваленту визначаємої речовини, г/моль;
V(p) – об’єм аналізуємого розчину (мірчої колби), мл;
Va - об’єм аліквоти аналізуємого розчину, мл.
Для оцінки правильності отриманих результатів розраховують відносну помилку визначення. Отриманий результат, наприклад (ρ експ.), порівнюють із істинним значенням (ρ іст.), і розраховують відносну помилку аналізу за формулою:
Qвідн.= 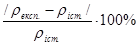
Qвідн не повинна перевищувати 6 %.