
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Визначення маси фосфорної кислоти в розчині
|
|
Сутність методу. Багатоосновні кислоти дисоціюють ступенево. Нейтралізація їх лугами протікає також ступенево з утворенням кислих і середніх солей. Кожному ступеню нейтралізації відповідає своя точка еквівалентності. Головним критерієм можливості визначення двох чи декількох кислот при спільній присутності є значення констант дисоціації. Таке визначення можливе при умові, якщо значення константи дисоціації однієї кислоти (К1) відрізняється від значення константи дисоціації другої кислоти (К2) не менше, ніж в 10000 разів. Багатоосновні кислоти також підпорядковуються цьому правилу, тому що багатоосновна кислота дисоціює за ступенями і тому її можна розглядати як суміш кислот.
При взаємодії Н3РО4 із сильною основою спостерігається три точки еквівалентності, що відповідають додаванню до 1 моль Н3РО4 1, 2 й 3 моль NаОН. Триосновна фосфорна кислота дисоціює за першим ступенем, як кислота середньої сили (рК = 1, 96), тому її можна титрувати в присутності метилового жовтогарячого. При цьому точці еквівалентності відповідає реакція:
H3PO4 + NaOH = Na2PO4 + HOН
У цьому випадку молярна маса еквівалента фосфорної кислоти дорівнює:

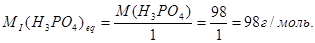
Друга константа дисоціації відносно невелика рК=6, 7. Тому фосфорну кислоту титрують як двуосновну кислоту в присутності фенолфталеїну.
 Н3РО4 + 2NaOH = Na2НРО4 + 2НОН
Н3РО4 + 2NaOH = Na2НРО4 + 2НОН
Молярна маса еквівалента Н3РО4 у цьому випадку дорівнює:

Значення третьої константи Н3РО4 дуже мале рК=11, 44. У цьому зв'язку зафіксувати третю точку еквівалентності не уєвляеться можливим.