
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способ 1. Атестація по стандартному розчину тетраборату натрію
|
|
Виконання роботи. Бюретку заповнюють розчином сірчаної кислоти. Чисту піпетку обполоскують розчином тетраборату натрію і, 10 мл його переносять у колбу для титрування. Додають одну (дві) краплі індикатора і титрують від жовтогарячого (жовтого) до рожевого забарвлення. Щоб краще помітити момент зміни забарвлення індикатора, титрують у присутності розчину «свідка».
Для приготування «свідка» відмірюють у колбу мірним циліндром 25 мл дистильованої води, додають одну краплю метилового жовтогарячого і одну краплю розчину сірчаної кислоти з бюретки, щоб вийшло слабке, але чітке рожеве або жовтогаряче забарвлення. Титрування тетраборату проводять до появи такої ж інтенсивності забарвлення, як і у «свідка». Титруємо до одержання не менше трьох разів збіжних результатів (об'ємів). Отримані результати титрування записують у робочий журнал. Об'єми розчину сірчаної кислоти, що витрачають на титрування, повинні відрізнятися не більше ніж на 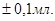 Розраховують середнє арифметичне значення об'єму (Vcеp) розчину сірчаної кислоти, що пішов на титрування.
Розраховують середнє арифметичне значення об'єму (Vcеp) розчину сірчаної кислоти, що пішов на титрування.
| № п/п | V(Н2SO4), мл | V(Na2B4O7), мл |
Vcер =
Обчислення. На основі отриманих даних обчислюють молярну концентрацію еквівалента розчину сірчаної кислоти за формулою (виходячи із закону еквівалентів):
С(Н2SO4)eq · V (H2SO4) = C(Na2B4O7)eq · V(Na2B4O7) або
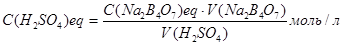 ,
,
де С(H2SO4)eq - молярна концентрація еквівалента сірчаної кислоти, моль/л;
V(H2SO4) – середній об'єм розчину сірчаної кислоти, витрачений на титрування, мл;
С(Na2B4O7)eq - молярна концентрація еквівалента розчину бури, моль/л;
V(Na2B4O7) – об'єм розчину бури, узятий на титрування, мл.