
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Визначення масової концентрації аміаку в розчині
|
|
Сутність методу. Аміак при розчиненні у воді утворює гідрат (NH3·H2O), у якого за рахунок утворення донорно-акцепторного зв'язку один із воднів води дуже відтягнутий до атома азоту води (NH3+HOH = NH4OH), а гідроксильна група ОН¯ при певних умовах може бути від’єднана. В зв'язку з тим аміак у воді створює лужне середовище і тому його можна титрувати розчином кислоти:
2NH3·HOH + H2SO4 = (NH4)2SO4 + 2HOH
З наведеного хімічного рівняння бачимо, що молярна маса еквівалента аміаку дорівнює молярній масі аміаку, тобто
М(NH3)eq = M(NH3) = 17г/моль
Сіль, що утворюється, має кислу реакцію за рахунок гідролізу. Тому точка еквівалентності буде перебувати в кислій області (рн< 7) і для її фіксування використовують індикатори - метиловий червоний або метиловий жовтогарячий.
Методика визначення. Одержують розчин аміаку в мірчій колбі місткістю 50 мл, розводять дистильованою водою до позначки та добре перемішують. Бюретку заповнюють атестованим розчиномH2SO4. Піпеткою Мора місткістю 10 мл відбирають аліквоту приготовленого розчину аміаку, переносять в колбу для титрування і туди ж доливають 1 - 2 краплі метилового червоного (метилового жовтогарячого). Титрують стандартизованим розчином сірчаної кислоти (H2SO4)до зміни забарвлення розчину з жовтого (жовтогорячого) на блідо-рожевий. Титрування проводять не менше трьох разів. Отримані результати титрування записують у робочий журнал. Об'єми розчину сірчаної кислоти, що витрачають на титрування, повинні відрізнятися не більше ніж на 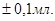 Розраховують середнє арифметичне значення об'єму (Vcеp) розчину сірчаної кислоти, що пішов на титрування.
Розраховують середнє арифметичне значення об'єму (Vcеp) розчину сірчаної кислоти, що пішов на титрування.
| № п/п | V(Н2SO4), мл | V(NH3· HOH), мл |
Vcер =
Обчислення. Масову концентрацію аміаку в аналізованому розчині обчислюють за формулою:
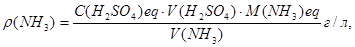
де 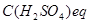 - молярна концентрація еквівалента атестованого розчину сірчаної кислоти, моль/л;
- молярна концентрація еквівалента атестованого розчину сірчаної кислоти, моль/л;
V(H2SO4) – середній об'єм розчину сірчаної кислоти, що пішов на титрування, мл;
V(NH3) – об'єм відібраного на аналіз розчину аміаку, мл.
Далі розраховують відносну помилку визначення.