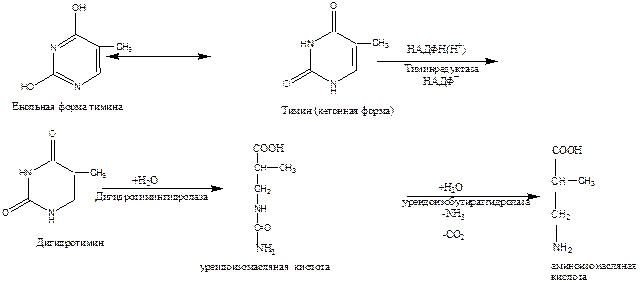Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Образование мочевины – основной путь обезвреживания аммиака в организме животных.
|
|
Последовательность реакций этого процесса, называемого также орнитиновым циклом, сформулировали в 1932 году Г.Кребс и К.Гензеляйт.
На первом этапе этого цикла аммиак вместе с СО2, образующимся в митохондриях в процессе дыхания, используется для синтеза карбамоилфосфата. Эта АТФ-зависимая реакция катализируется карбамоилфосфатсинтетазой. Далее карбамоилфосфат передает свою карбамоильную группу на орнитин с образованием цитруллина. Реакция протекает при участии фермента орнитинкарбамоилтрансферазы. Вышеуказанные реакции происходят в митохондриальном матриксе. В отличие от них последующие три реакции орнитинового цикла, приводящие в конечном итоге к образованию мочевины, протекают в цитозоле. Цитруллин вступает в реакцию конденсации с L-аспарагиновой кислотой. В результате реакции, катализируемой аргининосукцинатсинтетазой в присутствии АТФ, образуется аргининоянтарная кислота, которая на следующем этапе под действием аргининосукцинатлиазы расщепляется на фумаровую кислоту и аргинин. Фумаровая кислота может вовлекаться в ЦТК, связывая таким образом орнитиновый цикл и ЦТК (рис. 19). Аргинин подвергается действию аргиназы, в результате чего образуются мочевина и орнитин. Мочевина выделяется из организма в составе мочи. Орнитин может снова включаться в новый цикл обезвреживания аммиака.
CH2NH2 NH2
NH2 ½ ½
/ (СН2)2 C = O
NH3 + CO2 + Н2О + 2 АТФ ¾ ¾ ¾ ¾ ¾ ¾ ® С = О OH ½ ¾ ¾ ® ½
- 2 АДФ, Н3РО4 ½ / + СНNH2 - Н3РО4 NH +
O ~ P = O ½ ½
½ COOH (CH2)3
OH ½
карбамоилфосфат орнитин CHNH2
½
COOH
цитруллин
СООН NH2 COOH СООН NH2
½ АТФ ½ ½ ½ ½
+ H2N – C - H ¾ ¾ ¾ ¾ ¾ ® C = N - C - H ¾ ¾ ¾ ® С – Н C = NH ½ ç АМФ, Н4Р2О7 ½ ½ ê ê + ½
CH2 NH CH2 Н - С NH
½ ½ ½ ½ ½
COOH (CH2)3 COOH СООН (CH2)3
½ ½
L - аспарагиновая СН NH2 фумаровая CHNH2
кислота ½ кислота ½
COOH COOH
аргининоянтарная кислота аргинин
(аргининосукцинат)
NH2
½ NH2
(CH2)3 ½
Н2О ½ + C = O
¾ ¾ ¾ ¾ ® CHNH2 ½
½ NH2
COOH
орнитин мочевина
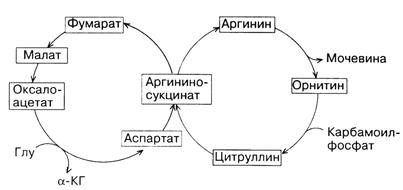
Рис. 19. Взаимосвязь орнитинового цикла с ЦТК.
Один из атомов азота мочевины происходит из аммиака, другой – из аспарагиновой кислоты, углеродный атом – из СО2. Переносчиком этих атомов углерода и азота служит орнитин.
Стехиометрия процесса синтеза мочевины следующая:
СО2 + NH3 + 3 АТФ + аспарагиновая кислота + 2 Н2О ¾ ¾ ® мочевина +
2 АДФ+ 2 Н3РО4 + АМФ + Н4Р2О7 + фумаровая кислота
Пирофосфат быстро гидролизуется, и таким образом, для синтеза одной молекулы мочевины используются 4 высокоэнергетические фосфатные связи.
Из всего азота мочи на долю азота мочевины у животных приходится от 80 до 90 % (при избыточном белковом кормлении доля азота мочевины возрастает, а при недостаточном или неполноценном белковом кормлении эта величина снижается до 56 – 60 %).
· Особенности обмена отдельных аминокислот
O
//
Глицин СН2 – С – ОН
½
NH2
Заменимая аминокислота. Используется в организме животных для синтеза белков, глутатиона, пуриновых оснований, порфиринов, глюкозы и гликогена, серина, креатина, гиппуровой и гликохолевой кислот.
O
//
a-аланин СН3 – СН – С – ОН
½
NH2
Заменимая аминокислота. Участвует в синтезе белков, глюкозы и гликогена.
O
//
Серин СН2 – СН – С – ОН
½ ½
OH NH2
Заменимая аминокислота. Используется для синтеза белков, глицина, глюкозы и гликогена, этаноламина, фосфатидов.
O
//
Цистеин СН2 – СН – С – ОН
½ ½
SH NH2
Заменимая аминокислота. Участвует в синтезе белков, глутатиона, глюкозы и гликогена, таурина, аминоэтантиола, коэнзима А.
O
//
Метионин СН2 – СН2 – СН – С - ОН
½ ½
S - CH3 NH2
Незаменимая аминокислота. Входит в состав белков, участвует в синтезе глюкозы и гликогена, цистеина, адреналина, холина, креатина.
O
//
Треонин СН3 – СН – СН – С - ОН
½ ½
ОН NH2
Незаменимая аминокислота. Используется в организме животных для синтеза белков, глюкозы и гликогена, глицина.
O
//
Валин СН3 – СН – СН – С - ОН
½ ½
СН3 NH2
Незаменимая аминокислота. Участвует в синтезе белков, глюкозы и гликогена.
O
//
Лейцин СН3 – СН – СН2 - СН – С - ОН
½ ½
СН3 NH2
Незаменимая аминокислота. Участвует в синтезе белков и кетоновых тел.
O
//
Изолейцин СН3 – СН2 – СН - СН – С - ОН
½ ½
СН3 NH2
Незаменимая аминокислота. Участвует в синтезе белков, глюкозы, гликогена и кетоновых тел.
O
//
Лизин СН2 – (СН2)3 – СН – С – ОН
÷ ÷
NH2 NH2
Незаменимая аминокислота. Используется для синтеза белков, глюкозы, гликогена, кетоновых тел.
Аспарагиновая кислота НООС – СН2 – СН - СООН
½
NH2
Заменимая аминокислота. Входит в состав белков. Участвует в синтезе глюкозы и гликогена, пиримидиновых оснований нуклеиновых кислот, реакциях трансаминирования, нейтрализации аммиака.
Аспарагин. Заменимая аминокислота.
Участвует в синтезе белков, глюкозы, гликогена, CООOH
нейтрализации аммиака. ½
CHNH2
½
CH2
½
C = O
½
NH2
Глутаминовая кислота НООС – СН2 – СН2 – СН - СООН
½
NH2
Заменимая аминокислота. Входит в состав белков, глутатиона. Участвует в синтезе глюкозы и гликогена, реакциях трансаминирования, окислительного дезаминирования, нейтрализации аммиака.
Глутамин. Заменимая аминокислота.
Участвует в синтезе белков, глюкозы, гликогена, пуриновых оснований нуклеиновых кислот, нейтрализации аммиака.
CООH
½
CHNH2
½
CH2
½
CH2
½
C = O
½
NH2
Аргинин. Заменимая аминокислота. Участвует в синтезе белков, глюкозы. Промежуточный метаболит орнитинового цикла.
CООН
ú
CHNH2
ú
(CH2)2
ú
CH2
ú
NH
ú
C = NH
ú
NH2
Фенилаланин - незаменимая аминокислота, используется в организме для синтеза белков, глюкозы и гликогена, кетоновых тел. Из фенилаланина под действием фенилаланингидроксилазы образуется тирозин. Он используется для тех процессов, что и тирозин. Кроме того, участвует в образовании гормонов щитовидной железы, мозгового слоя надпочечников, пигмента меланина, нейромедиатора дофамина.

Триптофан – незаменимая аминокислота. Участвует в синтезе белков, глюкозы и гликогена, кетоновых тел, НАД, серотонина.
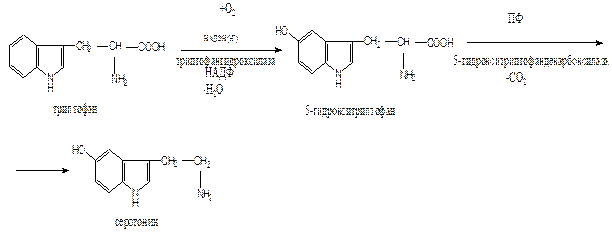
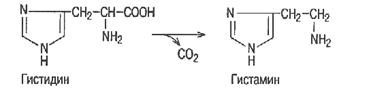
Гистидин – заменимая аминокислота. Используется в организме для синтеза белков, глюкозы и гликогена, гистамина.
Пролин – заменимая аминокислота. Участвует в синтезе белков, глюкозы и гликогена.
· биосинтез белка
Белки в организме находятся в динамическом состоянии, подвергаясь постоянным процессам синтеза и распада. В ходе жизнедеятельности белки постепенно «изнашиваются» – разрушаются их четвертичная, третичная, вторичная и первичная структуры, инактивируются функциональные группы, разрушаются связи в белковой молекуле. Возникает необходимость в замене «изношенных» белков новыми.
В зависимости от степени повреждения белковой молекулы происходит ее частичное или полное обновление. В первом случае под влиянием специальных ферментов обновляются небольшие участки полипептидных цепей или отдельные аминокислотные остатки. Во втором случае происходит полная замена «изношенной» молекулы белка новой. Белки распадаются под действием тканевых протеаз (катепсинов), локализованных в лизосомах.
Белки организма в целом обновляются в течение 135 – 155 дней. Скорость обновления белков различных органов и тканей неодинакова. Белки печени, поджелудочной железы, плазмы крови, стенки кишечника обновляются в течение 10 дней, мышц – 30, коллагена – 300. Синтез молекулы белка в клетке протекает за 2 – 5 с.
Белоксинтезирующая система включает следующие компоненты:
1. Протеиногенные аминокислоты.
2. Ферменты аминоацил-т-РНК-синтетазы. Они обладают специфичностью к опре- деленной аминокислоте и т-РНК.
3. т-РНК (их должно быть не менее 20). Они также обладают двойной специфичностью (к определенной аминокислоте и к определенному ферменту).
4. и-РНК.
5. Рибосомы. Они по химической природе представляют собой рибонуклеопротеины, состоящие из РНК (50 – 65 %) и белков (35 – 50 %).
6. АТФ и ГТФ.
7. Белковые факторы, ряд из которых обладает ферментативной активностью.
8. Ионы К+ и Мg2+.
Процесс образования белков в организме осуществляется по принципу матричного синтеза с участием нуклеиновых кислот.
В современной матричной или адапторной теории биосинтеза белка различают следующие этапы – транскрипцию, рекогницию и трансляцию.
В ходе транскрипции (от лат. transcriptio - переписывание) на ДНК-матрице осуществляется синтез РНК (в т.ч. и-РНК) по принципу комплементарности. Двухцепочная ДНК раскручивается на определенном участке и при участии фермента РНК-полимеразы начинается синтез и-РНК. Для ее синтеза используются рибонуклеозидтрифосфаты – АТФ, ГТФ, ЦТФ и УТФ.
Рекогниция ( от лат. recognition – узнавание) – стадия подготовки аминокислот к процессу трансляции.
Образование пептидной связи между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты термодинамически невыгодно. Этот термодинамический барьер преодолевается путем активации карбоксильной группы аминокислот-предшественников. Активированными промежуточными продуктами синтеза белка служат эфиры аминокислот, в которых карбоксильная группа аминокислоты связана с 2½ - или 3½ -ОН группой рибозного остатка на 3½ -конце т-РНК. Этот активированный промежуточный продукт называется аминоацил-т-РНК.
Присоединение аминокислоты к т-РНК имеет значение не только потому, что при этом активируется ее карбоксильная группа и она может образовать пептидную связь, но и потому, что аминокислоты сами по себе не способны узнавать кодоны и-РНК. Аминокислоты переносятся к рибосомам специфическими т-РНК, которые и узнают кодоны и-РНК. Таким образом, эти т-РНК выполняют роль адапторных молекул.
Активация аминокислот и их последующее присоединение к т-РНК катализируется специфическими аминоацил-т-РНК-синтетазами.
O O
// АТФ, т-РНК //
R – CH - C – OH ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ® R – CH - C – т-РНК
÷ аминоацил-т-РНК-синтетаза ½
NH2 АМФ, Н4Р2О7 NH2
аминокислота
аминоацил-т-РНК
Этот процесс протекает через стадию образования аминоацил-АМФ (аминоациладенилата).
Аминоацил-т-РНК далее поступает на рибосомы, где происходит процесс трансляции (от лат. translatio – перенесение), включающий 3 стадии (рис.20) – инициацию (начало синтеза полипептидной цепи), элонгацию (удлинение) и терминацию (окончание синтеза).
Процесс инициации начинается с ассоциации малой субъединицы рибосомы, и-РНК и метионил-т-РНК. Образованию этого комплекса способствуют белковые факторы инициации и ГТФ в присутствии ионов Mg2+. На следующем этапе инициирующий комплекс взаимодействует с большой субъединицей рибосомы и образуется функционально активная рибосома. Этот процесс сопровождается гидролизом ГТФ.
Метионил-т-РНК связана антикодоном т-РНК с инициирующим кодоном и-РНК АУГ и занимает на рибосоме Р-участок (пептидильный). А-участок (аминоацильный) остается свободным.
Каждый цикл элонгации включает 3 этапа: 1) связывание аминоацил-т-РНК (узнавание кодона); 2) образование пептидной связи; 3) транслокация.
Цикл элонгации начинается с введения новой аминоацил-т-РНК (в зависимости от кодона и-РНК) в свободный А-участок рибосомы. Комплементарная аминоацил-т-РНК доставляется в А-участок белком, который называется фактором элонгации. Когда аминоацил-т-РНК занимает на рибосоме правильное положение, происходит гидролиз ГТФ.
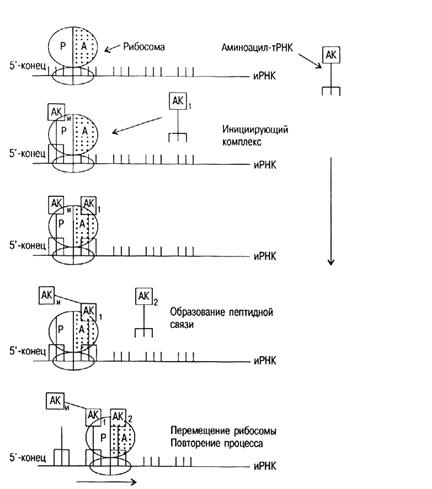
Рис. 20. Схема синтеза белка.
Образование пептидной связи происходит следующим образом. Метионин (а в последующем дипептид, трипептид, тетрапептид и т. д.) переносится с т-РНК, занимающей Р-участок на аминокислоту, связанную с т-РНК, находящейся в А-участке. Этот процесс катализирует фермент пептидилтрансфераза, входящий в состав большой субъединицы рибосомы. После образования пептидной связи ненагруженная т-РНК занимает Р-участок, а дипептидил-т-РНК (трипептидил-т-РНК, тетрапептидил-т-РНК и т.д.) занимает А-участок.
Следующий этап цикла элонгации – транслокация. Здесь происходят 3 перемещения: 1) ненагруженная т-РНК покидает Р-участок; 2) пептидил-т-РНК переходит из А-участка в Р-участок; 3) и-РНК перемещается вдоль рибосомы на один кодон. В результате этих перемещений в освобожденном А-участке появляется новый кодон и-РНК. Во время транслокации происходит гидролиз ГТФ.
Сигналом для завершения синтеза полипептидной цепи на стадии терминации являются терминирующие кодоны УАА, УАГ, УГА. Эти кодоны узнаются специальным белковым фактором терминации. Он взаимодейтвует с рибосомой и индуцирует гидролиз сложноэфирной связи между т-РНК и полипептидом. Т-РНК и полипептидная цепь покидают рибосому, которая диссоциирует на малую и большую субъединицы и готовится к синтезу новой полипептидной цепи. Эффективность процесса трансляции повышается, когда одна молекула и-РНК транслируется большим количеством рибосом. Образующиеся при этом структуры получили название полисом.
Многие полипептиды, образующиеся при трансляции и-РНК – еще не окончательные продукты. Они могут быть впоследствии модифицированы различными способами.
1. Под действием аминопептидазы может произойти отщепление одного или нескольких N-концевых остатков. Концевой метионин иногда отщепляется в то время, когда синтез остальной полипептидной цепи еще продолжается.
2. При окислении двух сульфгидрильных групп образуются дисульфидные связи.
3. Боковые цепи некоторых аминокислот могут быть специфически модифицированы. Например, некоторые остатки пролина и лизина в проколлагене гидроксилируются. Гликопротеины образуются путем присоединения углеводного компонента к боковым цепям аспарагина, серина и треонина. Некоторые белки фосфорилируются. К простым белкам присоединяются простетические группы.
4. Полипептидные цепи могут подвергаться специфическому расщеплению. Например, при превращении проколлагена в коллаген и проинсулина в инсулин.
Таким образом, пострансляционные реакции обеспечивают функциональную активность образующихся белков.
Биосинтез белка может происходить и в митохондриях, где имеется полная система переноса генетической информации от ДНК к белку. Размер ДНК митохондрий не позволяет им кодировать синтез всех необходимых этим органеллам белков, поэтому часть из них синтезируется на рибосомах с последующим встраиванием внутрь митохондрий.
· обмен сложных белков
Хромопротеины – это сложные белки, простетической группой которых является окрашенный компонент. Наиболее распространенной группой хромопротеинов являются г емопротеины (гемоглобин, миоглобин, циохромы, каталаза, пероксидаза).
Они могут поступать в организм животных в составе кормов животного происхождения (мясо-костная мука, кровяная мука и др.). В желудке под действием соляной кислоты они гидролизуются на простой белок (глобин) и красящее вещество – гем.
Белок под действием пепсина желудка, трипсина, химотрипсина, карбоксипептидаз, аминопептидаз и дипептидаз кишечного сока распадается до свободных аминокислот, которые всасываются в кровь и пополняют аминокислотный фонд организма.
Простетическая группа – гем под влиянием соляной кислоты окисляется в гематин, который всасывается в кровь плохо и поэтому выделяется из организма с калом в неизменном виде или в виде различных продуктов, образующихся под действием бактериальной ферментации в толстом отделе кишечника и преджелудках жвачных животных.
Средний срок жизни эритроцитов составляет 100 – 120 дней. Деструкции подвергается и содержащийся в эритроцитах гемоглобин. Процесс распада начинается уже в сосудистом русле, а завершается в клеточных элементах системы фагоцитирующих мононуклеаров (купферовских клетках печени, селезенки, гистиоцитах соединительной ткани, плазматических клетках костного мозга). После выхода гемоглобина из структуры эритроцитов так называемый внеэритроцитарный гемоглобин связывается с гаптоглобином плазмы, образуя комплекс «гемоглобин – гаптоглобин». Благодаря этому гемоглобин задерживается в сосудистом русле, не проходя через почечный фильтр.
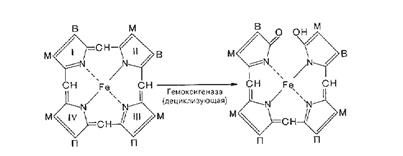
В процессе распада гемоглобина в клеточных элементах СМФ вначале происходит разрыв метинового мостика между I и II пиррольными ядрами порфиринового кольца (рис. 21) с одновременным окислением двухвалентного железа в трехвалентное. Образующийся таким образом высокомолекулярный пигмент зеленого цвета вердоглобин представляет собой комплекс, состоящий из глобина, разорванной системы порфиринового кольца и трехвалентного железа. Дальнейшие превращения приводят к потере вердоглобином железа и глобина, в результате чего формируется низкомолекулярный желчный пигмент зеленого цвета – биливердин. Он почти весь ферментативным путем восстанавливается в красно-желтый пигмент желчи – билирубин, являющийся обычным компонентом плазмы крови.
При распаде 1 г гемоглобина образуется 34 мг билирубина. Будучи нерастворимым в воде, свободный билирубин соединяется с альбумином плазмы, который служит основным его транспортером в плазме крови (в физиологических условиях 1 г альбумина связывает 17 мг билирубина).
 |
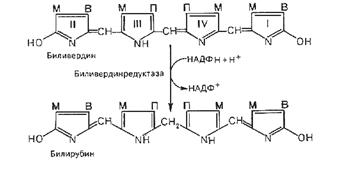 |
Рис. 21. Схема образования биливердина и билирубина.
Комплекс “альбумин – билирубин”, доставленный с током крови в печень, на поверх -
ности плазматической мембраны гепатоцита подвергается диссоциации. При этом высвобожденный билирубин образует временный ассоциат с липидами плазматической мембраны и перемещается через нее благодаря деятельности определенных ферментных систем.
В клетках печени под влиянием фермента УДФ-глюкуронилтрансферазы, осуществляющей перенос активных форм молекулы глюкуроновой кислоты (уридиндифосфоглюкуроновой кислоты) на свободный билирубин, образуются билирубиндиглюкурониды (75–80 %) и билирубинмоноглюкурониды (25–30 %). Этот процесс называется конъюгацией. Связанный (конъюгированный) билирубин достаточно хорошо растворим в воде, но лишен способности перемещаться через липидный слой мембраны. За счет связывания билирубина с глюкуроновой кислотой присущая свободному билирубину токсичность в значительной мере теряется. Лишь незначительная часть связанного билирубина реэкскретируется в кровь, где составляет не более 25 % от общего количества билирубина.
Билирубинглюкурониды благодаря ферментным системам мембран активно перемещаются через них (против градиента концентрации) в желчные ходы, выделяясь вместе с желчью в просвет кишечника. В нем под действием ферментов, продуцируемых кишечной микрофлорой, происходит разрыв глюкуронидной связи. Высвобожденный свободный билирубин через ряд реакций превращается в уробилиноген. В норме определенная его часть, всасываясь в тонком кишечнике и в верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается (путем окисления), превращаясь в дипиррольные соединения.
Уробилиноген при этом в общий кровоток не поступает. Часть его вместе с продуктами разрушения вновь направляется в просвет кишечника.
Основная масса уробилиногена направляется из тонкого кишечника в толстый, где под влиянием анаэробной микрофлоры превращается в стеркобилиноген. Он почти полностью выделяется с калом, окисляясь на воздухе в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена путем всасывания через слизистую оболочку толстого кишечника попадает в систему нижней полой вены, доставляется с кровью в почки и выделяется с мочой.
Таким образом в моче здоровых животных отсутствует уробилиноген, но в ней содержится небольшое количество стеркобилиногена. У новорожденных из-за стерильности кишечника билирубин не превращается в его перечисленные производные (метаболиты), но активно всасывается в кровь, обуславливая гипербилирубинемию.
В сыворотке крови в норме на долю свободного билирубина приходится 75 %, а связанный (конъюгированный) занимает 25 %.
Патология обмена билирубина проявляется наличием желтухи.
Различают 3 основных типа желтух: паренхиматозные (печеночные), механические (обтурационные) и гемолитические.
Паренхиматозные желтухи возникают в результате диффузного поражения паренхимы печени различными агентами (вирусы, бактериальные поражения печени, паразитарное обсеменение органа, отравления дихлорэтаном, четыреххлористым углеродом, свинцом и др., длительное применение сильнодействующих лекарственных веществ).
В патогенезе паренхиматозных желтух ведущим моментом является нарушение обменных и трофических процессов в пораженных гепатоцитах. Увеличиваясь в размерах, они пережимают мельчайшие желчные ходы, вызывая застой желчи – так называемый первичный холестаз. В результате задерживается и выведение желчных пигментов, накапливаясь, они подвергаются обратному всасыванию в кровь. В крови увеличивается содержание связанного билирубина, что приводит к появлению его в моче (моча приобретает темную окраску с пеной желто-коричневого цвета). Содержание свободного билирубина в крови тоже возрастает (поскольку пораженная печеночная клетка не в состоянии превратить все количество дошедшего до нее свободного билирубина, но в меньшей степени). Наиболее тонким признаком поражения печени при гепатитах является появление уробилиногена в моче (табл. 6). Кал обесцвечен на высоте желтухи (отсутствует стеркобилин).
Этиологическим фактором механических желтух являются какие-либо препятствия оттоку желчи, локализующиеся вне самой печени. Обычно они возникают на уровне желчного пузыря или крупных желчевыводящих протоков. Такими препятствиями могут быть камни желчного пузыря и желчевыводящих путей, злокачественные новообразования желчевыводящих путей, либо опухоли близлежащих к печени органов.
В результате закупорки крупных желчевыводящих путей развивается так называемый вторичный холестаз и, как следствие, гипербилирубинемия. Причем, как и при паренхиматозных желтухах, концентрация билирубина в крови возрастает за счет связанной его формы. В моче, пропорционально степени обтурации возрастает уровень связанного билирубина. Кал обесцвечен.
Таблица 6. Клинико-биохимическая дифференциальная диагностика желтух по данным исследования пигментного обмена.
| Тип желтухи | В крови | В моче | В кале | ||||||
| Билирубин | Стерко- билин (оген) | Уробили- ноген | Билирубин | Стеркобилин (оген) | Билирубин | ||||
| Своб. | Связ. | Своб. | Связ. | Своб. | Связ. | ||||
| Норма | + | (-) | + | - | + | - | - | - | |
| Паренхиматозная | | | + | | - | + | + | (+) | - |
| Обтурационная | | | - | (+) | - | + | - | - | - |
| Гемолитическая | | (+) | | - | - | - | | | - |
Условные обозначения:
(-), (+) - содержание пигмента практически не определяется используемыми методами
- и + - отсутствие или наличие пигмента
- увеличенное содержание
и - резко и очень резко увеличенное содержание пигмента
Гемолитические желтухи развиваются в результате усиленного распада эритроцитов с освобождением из них значительных количеств гемоглобина. В зависимости от причины возникновения гемолитические желтухи подразделяются на врожденные и приобретенные. К врожденным можно отнести гемолитическую желтуху новорожденных. К приобретенным относят случаи, связанные с отравлениями гемолитическими ядами (красная кровяная соль, синильная кислота и ее соли, нитраты и др.), либо укусами ядовитых животных с гемолитическим действием ядов. В крови отмечается гипербилирубинемия, но в отличие от первых двух типов желтух, она обусловлена преимущественно свободным билирубином (т.к. печень не успевает его переработать). В моче билирубин не определяется (свободный билирубин, связанный с альбумином, через почечные мембраны не фильтруется). Окраска мочи и кала в этом случае темная (высокое содержание стеркобилина).
Для синтеза простетичекой группы гемопротеинов гема используются тетрагидрофолиевая кислота (ТГФК), витамин В12, медь, железо, глицин, активная уксусная кислота, активная пропионовая кислота и активная янтарная кислота. Белковая часть синтезируется обычным путем из аминокислот в результате процесса трансляции. Присоединение гема к глобину происходит в результате посттрансляционной модификации.
Нуклеопротеины – это сложные белки, простетической группой которых является нуклеиновая кислота (РНК или ДНК). Различают рибонуклеопротеины и дезоксирибонуклеопротеины. Они поступают в организм в составе кормов животного происхождения (мясокостная, рыбная мука) и дрожжей.
В желудке от нуклеопротеинов под воздействием пепсина и соляной кислоты отщепляется часть белка, а в тонком кишечнике при участии трипсина – оставшийся белок с освобождением нуклеиновой кислоты. В дальнейшем белок в тонком кишечнике гидролизуется до свободных аминокислот (под действием трипсина, химотрипсина, карбоксипептидаз, аминопептидаз и дипептидаз).
Нуклеиновые кислоты расщепляются в тонком отделе кишечника под действием рибонуклеазы (РНК-азы) и дезоксирибонуклеазы (ДНК-азы) поджелудочной железы и кишечного сока. Эти ферменты гидролизуют нуклеиновые кислоты преимущественно до мононуклеотидов и небольшого количества олигонуклеотидов. Нуклеотиды могут гидролизоваться кишечными фосфатазами с образованием нуклеозидов и ортофосфорной кислоты.
В тканях нуклеозиды и мононуклеотиды используются для синтеза нуклеиновых кислот или могут распадаться до конечных продуктов обмена.
Рибо- и дезоксирибонуклеотиды под действием ферментов нуклеотидаз (фосфатаз) клеток распадаются с образованием нуклеозидов и ортофосфорной кислоты по схеме:
АМФ (ГМФ, ЦМФ, УМФ) + НОН ® аденозин (гуанозин, цитидин, уридин) + Н3РО4
дАМФ (дГМФ, дЦМФ, ТМФ) + НОН ® дезоксиаденозин (дезоксигуанозин, дезоксицитидин, тимидин) + Н3РО4
Затем под действием фосфорилазы от каждого нуклеозида отщепляется моносахарид в виде рибозо-1-фосфата (или дезоксирибозо-1-фосфата) и образуется соответствующее азотистое основание (аденин, гуанин, цитозин, урацил или тимин).
Превращение аденина в мочевую кислоту осуществляется через стадии образования гипоксантина и ксантина. Гуанин превращается в мочевую кислоту непосредственно через ксантин.
Мочевая кислота является конечным продуктом распада пуриновых азотистых оснований у человека и птиц. У лошадей, собак и кроликов мочевая кислота далее превращается в аллантоин.
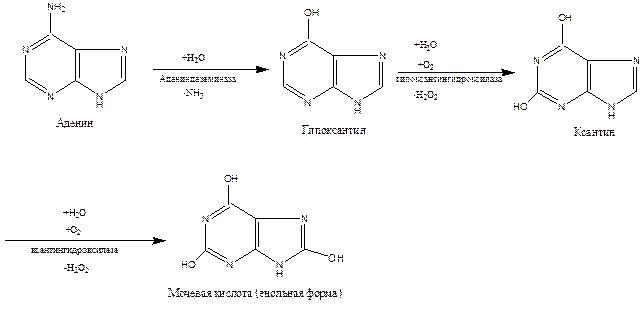
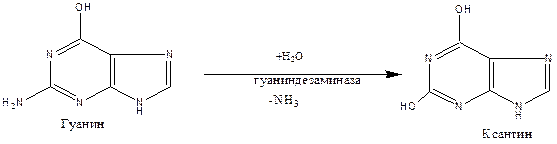
Далее ксантин превращается в мочевую кислоту.
Нарушение метаболизма мочевой кислоты приводит к подагре.
Распад пиримидиновых азотистых оснований происходит по следующей схеме:

Распад тимина происходит по такой же схеме с образованием b-аминоизомасляной кислоты.