
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изучение кинетики разложения перекиси водорода газометрическим методом
|
|
Распад Н2О2 в водных растворах при обычных температурах идет довольно медленно: 2 H2O2 → 2 H2O + O2
Увеличение скорости разложения происходит под влиянием различных катализаторов:
- гомогенный катализ: в присутствии водных растворов ионов – Сr2O72-; I −;
WO42-; Fe2+; Fе;
- гетерогенный катализ: металлы (Pt, Co, Cu, Ni и др.), оксиды (MnO2, Al2O3 и др.).
Катализ разложения H2O2 хлорным железом происходит по общей схеме:
А + К ↔ М → продукты + К
где А - перекись водорода, К - катализатор.
Равновесие устанавливается быстро, и скорость определяющей стадией является распад промежуточного комплекса М.
Порядок по концентрации H2O2 первый и для расчета константы скорости используют уравнение (12). Для измерения скорости разложения применяют газометрический метод, определяя количество разложившейся к данному моменту времени перекиси по объему выделившегося кислорода. Начальная и текущая концентрации H2O2 пропорциональны, соответственно, объемам кислорода, выделившегося к концу реакции Vk и разности между Vk и текущим объемом кислорода Vt. Тогда уравнение (12) для расчета константы скорости реакции будет иметь вид:
 (28)
(28)
Порядок выполнение работы
Для изучения скорости разложения перекиси водорода применяют установку, показанную на рис.9, которая позволяет измерять объем выделяющегося кислорода. В одно колено реактора 1 (рис.9) с помощью пипетки помещают 10 мл 3% раствора перекиси водорода, а во второе - 0.5, 1 или 1.5 мл (по указанию преподавателя) раствора хлорного железа и с помощью пробки 2 соединяют реакционный сосуд с измерительной системой.
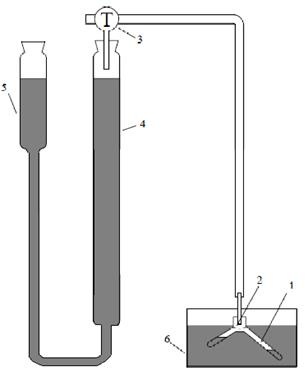
Рис. 9. Схема установки для изучения скорости разложения перекиси водорода:
1 - реакционный сосуд, 2 - пробка, соединяющая реакционный сосуд с мерной бюреткой 4,
3 - трехходовой кран, 5 – уравнительный сосуд, 6 – термостат.
Перед началом эксперимента проверяют герметичность системы. Для этого приводят давление внутри системы к атмосферному, уравняв на произвольной высоте жидкость в бюретке 4 и уравнительном сосуде 5, несколько раз поворачивают кран 3 так, чтобы пространство над жидкостью сообщалось то с реакционным сосудом, то с атмосферой. Соединив бюретку 4 с атмосферой, поднимают уравнительный сосуд 5, чтобы заполнить бюретку жидкостью до нулевой отметки, после чего соединяют бюретку 4 с реактором 1 и опускают сосуд 5 примерно на четверть высоты бюретки. Если обеспечена герметичность, то уровень затворной жидкости в бюретке 4 не должен смещаться в течение 2-3 минут.
После проверки герметичности приступают к выполнению эксперимента. Для этого перекись водорода переливают в колено с катализатором, смесь встряхивают. Время смешения принимают за время начала реакции. Измерения ведут каждую минуту. Уровень жидкости в уравнительном сосуде 5 поддерживают на уровне жидкости в мерной бюретке 4. Измерения заканчивают, если в течение 5-10 мин. объем кислорода не увеличивается.
Если в ходе реакции объем мерной бюретки окажется недостаточным, следует, по возможности быстро, с помощью крана 3 соединить бюретку 4 с атмосферой. С помощью сосуда 5 установить уровень жидкости в бюретке на нулевой отметке и вновь краном 3 соединить реакционный сосуд 1 с бюреткой 4. Продолжать измерения, прибавляя объем кислорода, выпущенный в атмосферу.
По окончании процесса выделения пузырьков кислорода приступают к определению Vk. Для этого реакционный сосуд 1 помещают в водяную баню с температурой воды 70-800С и выдерживают его при этой температуре до тех пор, пока объем выделившегося кислорода не будет изменяться в течение 5-10 минут. Затем реакционный сосуд охлаждают до комнатной температуры и фиксируют значение Vk. Результаты измерений и расчеты привести в табл.1, предварительно заполнить следующие данные:
Объем перекиси водорода мл
Катализатор и его объем мл
Температура опыта оС
Объем кислорода по окончании реакции Vk, мл
Таблица 1. Выделение О2 во времени и определение константы скорости разложения Н2О2
| № пп | t, мин | Vt, мл | Vk-Vt | ln(Vk/(Vk-Vt)) | k, мин-1 |
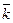 = =
|
По полученным данным построить график зависимости ln(Vk − Vt) = f (t) и определить константу скорости реакции k (рис.3). Данные первых трех или четырех замеров можно отбросить, т.е. использовать измерения в условиях уже установившегося режима процесса. Сделать вывод о величинах k, полученных аналитическим и графическим методами.
Для определения энергии активации E реакции необходимо провести опыт при разных температурах, заданных преподавателем. Рассчитать E по уравнению (27) и графическим способом при построении зависимости ln k от 1/T.