
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Результаты экспериментов сводят в таблицу.
|
|
В начале таблицы помещают данные, необходимые для расчета:
концентрация раствора HCl (г-экв/л) – 1, 0 Н
концентрация раствора I2 (г-экв/л) – 0, 1Н
объем ацетона в мл – 2 мл (ρ = 0, 79 г/см3)
а – число молей ацетона, молей (в 25 мл пробы) -
в – число молей Н+ (в 25мл) -
| № пп | Время от начала опыта, t мин | Vt | X | k | 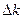
|
Строят график Сацетона = ƒ (t), где С = а – х.
7. Для определения энергии активации E данной реакции необходимо провести опыт при другой температуре, заданной преподавателем. Рассчитать E по уравнению (27) и графическим способом при построении зависимости ln k от 1/T.
Вопросы для самопроверки
1. Что называют скоростью химических реакций?
2. Приведите общую формулу кинетического уравнения для скорости химических реакций.
3. Что такое константа скорости химических реакций, от чего она зависит?
4. Что такое порядок, молекулярность реакции?
5. Приведите уравнения обеих стадий реакции йодирования ацетона.
6. Каким образом можно определить константу скорости реакции?
7. Почему необходимо уровень воды в уравнительном сосуде поддерживать одинаковым с уровнем воды в бюретке?
8. Почему нельзя начинать опыт сразу после достижения заданной температуры воды в термостате?
9. Что называется молекулярностью реакции? Чему она равна для реакции
разложения пероксида водорода?
10. Какие из следующих факторов влияют на константу скорости химической реакции: природа реагирующих веществ, концентрация реагирующих веществ, катализатор, растворитель, температура?
11. Имеет ли константа скорости реакции размерность и какую?
12. Во сколько раз увеличилась скорость реакции при изменении температуры на 10оС.
Литература
1. Киреев В. А. Курс физической химии. – М.: Химия, 1988.
2. Мищенко К. П., Равдель А. А. Практические работы по физической химии. – М.: Химия, 1987. – С. 221–253.
3. Справочник физико – химических величин/Под ред. К. П.Мищенко и А. А.Равделя. Л.: Химия, 1972. С. 200.