
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изучение кинетики реакции йодирования ацетона
|
|
В данной работе изучаются кинетика химической реакции на примере взаимодействия йода с ацетоном. Реакция йодирования ацетона протекает с заметной скоростью в щелочной или кислой среде. В кислой среде в присутствии ионов водорода (ионов гидроксония) происходит таутомерное превращение кетона в енол:
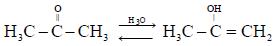 (29)
(29)
Данная реакция с константой скорости k1 идет медленно. Вторая стадия реакции, заключающаяся в присоединении йода к енольной форме ацетона, протекает быстро (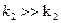 ):
):

Таким образом, реакция йодирования ацетона представляет собой последовательную двухстадийную реакцию, причем скорость суммарной реакции определяется скоростью медленной стадии (первой). Константа скорости k определяется из уравнения (30).
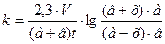 , (30)
, (30)
где а и в – начальные числа молей исходных веществ;
х – убыль числа молей вещества (а и в соответственно);
V – объем реакционной смеси, мл.
Исходное количество ацетона определяют по взятому объему, ионов водорода – по количеству взятого раствора кислоты определенной концентрации, количество израсходованного ацетона – по убыли йода, пошедшего на йодирование. В расчеты входит лишь одна переменная величина (х), которую определяют титрованием реакционной смеси раствором тиосульфата натрия.
Порядок выполнение работы
1. В мерную колбу на 250 мл наливают 25 мл 0, 1 Н раствора йода в 4%-ном растворе йодистого калия, прибавляют в нее 25 мл 1 Н раствора соляной кислоты и добавляют такой объем дистиллированной воды, чтобы до метки осталось около 30 мл.
2. В мерную колбу с раствором йода вносят 2 мл ацетона, тщательно перемешивают и сразу же доводят водой уровень раствора в колбе до метки. Этот момент является временем начала реакции. Отбирают в стакан емкостью 100 мл пробу объемом 25 мл для определения расхода тиосульфата в начальный момент реакции. Остальную часть раствора с колбой помещают в водяную баню с температурой 350 С (±2).
3. Из мерной колбы периодически отбирают пробы по 25 мл, добавляют к ним 25 мл 0, 1 Н раствора гидрокарбоната натрия (NaHCO3) и титруют 0, 01 H раствором тиосульфата натрия (Na2S2O3) в присутствии крахмала. Пробы отбирают в момент начала реакции, через 15, 30, 45, 60, 75, 90, 105, 120 минут после начала реакции.
4. Вычисляют х по формуле (31)
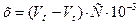 (31)
(31)
где Vo и Vt – объемы раствора тиосульфата, пошедшие на титрование в начальный момент и в момент t (мл);
С – концентрация раствора тиосульфата (г-экв/л).
5. По формуле (30) вычисляют k для каждого значения времени, определяют среднее значение константы скорости реакции и отклонение k от среднего значения в %.