
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Законы фотохимии
|
|
Закон Гротгуса – Дрепера (I законом фотохимии): только поглощенное средой световое излучение может произвести ее химическое изменение. Однако обратное утверждение о том, что лучи, которые поглощается, являются химически активными, в общем случае является неверным, так как поглощение света не обязательно приводит к химической реакции. Это условие необходимое, но недостаточное.
Поглощение монохроматического света с длиной волны l описывается объединенным законом Бугера - Ламберта – Бера: ослабление интенсивности dI света, прошедшего через слой толщиной dl, прямо пропорционально толщине слоя, интенсивности падающего света I и числу поглощающих частиц n (или их концентрации в слое):
– dI = kIdl
где коэффициент пропорциональности k – молекулярный коэффициент поглощения, который является мерой поглощательной способности молекулы для данной длины волны и в первом приближении не зависит от концентрации. После интегрирования в пределах от 0 до l (l -общая толщина поглощающего слоя) и I от I o (интенсивность падающего света) до I (интенсивность прошедшего света) получим выражение:
 .
.
Если концентрацию выражать числом молей вещества в литре раствора (c), то
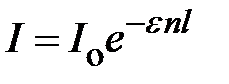 ,
,
e – молярный коэффициент поглощения, связанный с k соотношением kn = e c.
Отношение  – пропускание, а выражение
– пропускание, а выражение 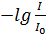 – поглощение среды или оптическая плотность.
– поглощение среды или оптическая плотность.
Количество световой энергии A, поглощенной в единицу времени фотохимической системой, равно:
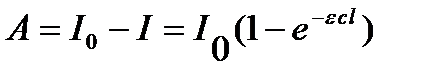 ,
,
Закон Вант-Гоффа - обобщение всех закономерностей: количество фотохимически измененного вещества пропорционально поглощенной энергии света. Количество фотохимически измененного вещества dc в единицу времени, т.е. скорость реакции, пропорциональна A:

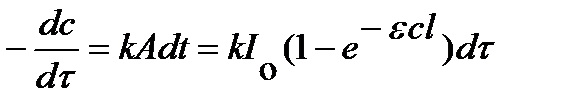 .
.
Если концентрация очень мала или поглощающий слой очень тонкий (величина cl мала), то после разложения экспоненты в ряд получим:
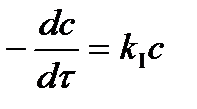 ,
,
т.е. фотохимическая реакция протекает по первому порядку, ее скорость пропорциональна концентрации реагирующего вещества.
При больших концентрациях или толстом поглощающем слое (cl велико, 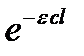 < < 1) весь световой поток поглощается:
< < 1) весь световой поток поглощается:
 ,
,
т.е. скорость реакции постоянна и не зависит от концентрации реагирующего вещества (нулевой порядок).
Закон фотохимической эквивалентностиШтарка – Эйнштейна (II закон фотохимии): каждый поглощенный квант света hn в первичном акте вызывает превращение одной молекулы.
Энергия моля квантов света:
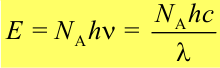
Число фотохимически прореагировавших молекул не равно числу поглощенных квантов. В связи с этим для характеристики фотохимических процессов введено понятие квантового выходаg. Различают первичный, вторичный и общий квантовые выходы.
Первичный квантовый выход (всегда < 1) равен отношению числа прореагировавших возбужденных молекул в первичном акте (n) к числу поглощенных квантов (A / hn):
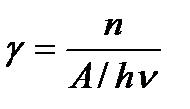
Тогда число прореагировавших молекул
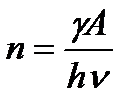
и скорость химической реакции
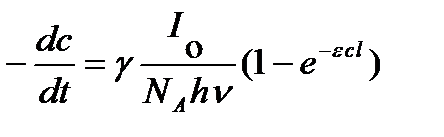
Это уравнение объединяет все законы фотохимии и представляет собой общее выражение для скорости фотохимической реакции.
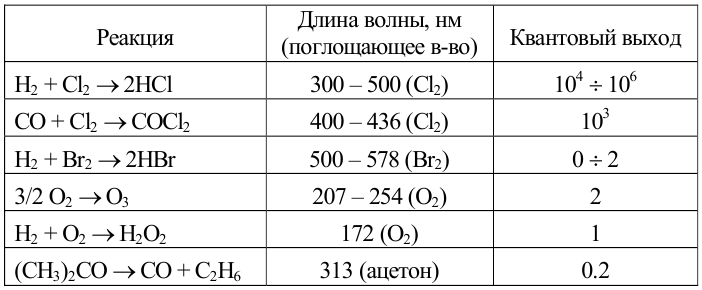
Общий квантовый выход равен отношению числа образовавшихся в процессе молекул продукта (или числа прореагировавших молекул реагента) к числу поглощенных квантов. Для реакций, протекающих в растворах < 1. При значениях» 1 рассматриваемый фотохимический процесс имеет цепной характер. Интервал возможных изменений: от 10-3 (фотохимическое разложение метилбромида) до 106 (цепная реакция водорода с хлором); в общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция.
Вторичный квантовый выход является мерой развития вторичных реакций и равен отношению числа образовавшихся в процессе молекул продукта к числу молекул, прореагировавших в первичном акте.
Характеристики некоторых фотохимических реакций
Основные типы фотохимических процессов
В зависимости от величины квантового выхода все фотохимические реакции можно подразделить на четыре группы: 1) с квантовым выходом g = 1; 2) с квантовым выходом g < 1; 3) с квантовым выходом g > 1; 4) с квантовым выходом g > > 1.
Механизм протекания фотохимической реакции включает три основные стадии:
1) начальный акт поглощения света;
2) первичный фотохимический процесс;
3) вторичные реакции.
Начальное действие света состоит в образовании электронно-возбужденной молекулы А*:
А + hn ® А*
Квантовый выход этого процесса в большинстве случаев равен единице.
За начальным актом поглощения немедленно следуют первичные процессы (физические и химические) превращения элекронно-возбужденной молекулы различного вида:
1. Флуоресценция А* ® А + hn
2. Дезактивация при соударении А* + М ® А + М
3. Спонтанная диссоциация А* ® В1 + В2
4. Диссоциация при столкновении А* + М ® В1 + В2 + М
5. Внутренняя перестройка А* ® В
6. Реакции с другими молекулами А* + В ® С
В результате процессов 1 – 2 возбужденная молекула дезактивируется и дальнейших превращений не происходит. В реакциях 5 – 6 образуются продукты и квантовый выход будет равен единице или меньше, если частично протекают также реакции 1 – 2. В результате диссоциации в реакциях 3 – 4 могут образоваться как устойчивые, так и реакционно-способные молекулы, а также свободные радикалы и атомы. Именно свободные радикалы и атомы чаще всего образуются в результате диссоциации и, обладая высокой реакционной способностью, вступают во вторичные реакции различного типа.
К вторичным процессам, протекающим без участия света относятся: реакции с активных частиц (атомов, радикалов), появившихся в результате первичного процесса с молекулами реагента; реакции дезактивации появившихся в первичном акте молекул; реакции рекомбинации свободных атомов и радикалов.
Иногда фотохимические процессы происходят под действием излучения, которое не поглощается реагирующими веществами. В таких случаях реакционная смесь должна содержать сенсибилизаторы. Механизм действия сенсибилизаторов заключается в том, что они поглощают свет, переходя в возбуждённое состояние, а затем при столкновении с молекулами реагентов передают им избыток своей энергии. Сенсибилизатором фотохимических реакций является, например, хлорофилл.