
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
IV.2. Гомогенный катализ
|
|
Каталитическим действием в гомогенной жидкой или газообразной фазе могут обладать нейтральные молекулы, положительные или отрицательные ионы, координационные комплексы и высокомолекулярные соединения (например, ферменты). Рассмотрим бимолекулярную реакцию
А + В ® [ A... В ]¹ ® D.
В отсутствие катализатора эта реакция протекает через образование переходного комплекса [ A... В ]¹ с последующим его превращением в вещество D. При введении катализатора (К) в систему возможны два основных механизма:
1). Катализатор образует промежуточный комплекс с обоими исходными реагентами:
А + В + К 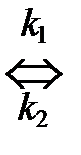 [ АВК ]¹
[ АВК ]¹ 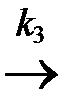 D + К.
D + К.
При этом, если выполняется условие k 1 < < k 2 < k 3, то промежуточный комплекс [ АВК ]* носит название комплекса Аррениуса и концентрация его мала (образующийся комплекс быстро либо распадается на исходные вещества, либо превращается в продукт реакции с выделением катализатора). Поскольку лимитирующей стадией реакции в данном случае является первая (образование комплекса), то в общем случае скорость реакции описывается следующим уравнением
υ = k 1· C A· C B· C К = k ¢ · C A· C B,
где С А, С В и С К — концентрации А, В и катализатора, k ¢ = k 1· C К — опытная константа скорости реакции (при условии, что С К = const).
Примером гомогенного катализа в жидкой фазе протекающего по данному механизму является кислотно-основный катализ в растворах, ферментативный катализ (например, гидролиз сложных эфиров).
2). Катализатор образует промежуточный комплекс только с одним из реагентов, при взаимодействии промежуточного комплекса с другим реагентом образуется продукт и выделяется катализатор:
А + К 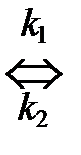 [ АК ]¹
[ АК ]¹
[ АК ]¹ + В  D + К.
D + К.
При этом, если выполняется условие k 1» k 2 > k 3, то промежуточный комплекс [ АК ]* носит название комплекса Вант-Гоффа. Для первой обратимой стадии образования комплекса в состоянии равновесия можно записать:
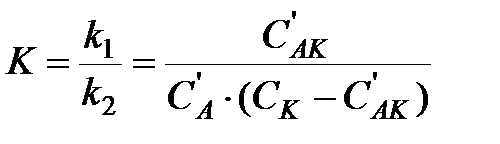 ,
,
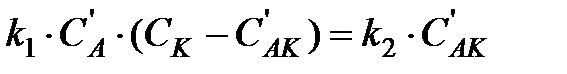 ,
,
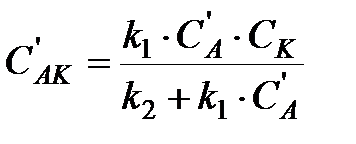 ,
,
где 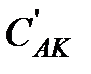 и
и 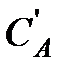 — равновесные концентрации промежуточного комплекса и реагента А, С К — общая концентрация катализатора (разность
— равновесные концентрации промежуточного комплекса и реагента А, С К — общая концентрация катализатора (разность 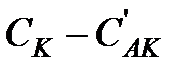 соответствует концентрации не вступившего в реакцию катализатора). Поскольку самой медленной, т.е. лимитирующей, стадией данной каталитической реакции является вторая, то скорость всей реакции (скорость образования вещества D) равна:
соответствует концентрации не вступившего в реакцию катализатора). Поскольку самой медленной, т.е. лимитирующей, стадией данной каталитической реакции является вторая, то скорость всей реакции (скорость образования вещества D) равна:
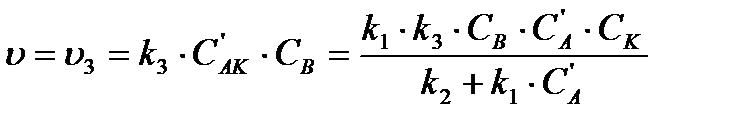 .
.
Рассмотрим два предельных случая:
а) Если  , то
, то
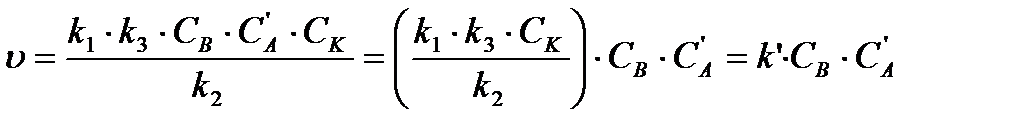 ,
,
где k ¢ — опытная константа скорости реакции (при условии, что С К = const). Следовательно, реакция будет протекать по уравнению реакции второго порядка.
б) Если 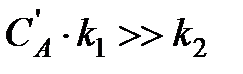 , то
, то
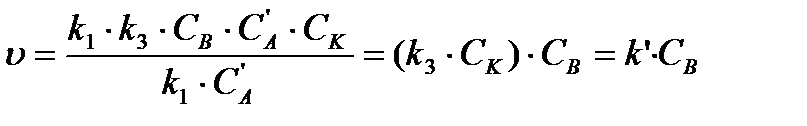
Реакция будет протекать по уравнению первого порядка и зависеть только от концентрации вещества В.
Примером гомогенного катализа в газовой фазе, использующегося в химической промышленности, может служить процесс окисления оксида серы (IV) SO2 в оксид серы (VI) SO3 под действием оксидов азота (II, IV):
SO2 + NO2 ® SO3 + NO
NO + 1/2O2 ® NO2.
Суммарная реакция SO2 + 1/2O2 ® SO3.