
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общая характеристика топохимических реакций
|
|
Топохимическая реакция – гетерогенная реакция, в которой участвует по крайней мере одно твердое исходное вещество и один твердый продукт реакции.
Различают 3 основных типа т-х. реакций:
1- термическое разложение твердых веществ
2- реакции твердых веществ с активным газом
3- реакции твердых веществ с жидкостью.
Для всех т-х. реакций характерна одна особенность - процесс идет на границе раздела двух твердых фаз - исходного вещества и продукта. С этим связано название (topos по гречески «место») и особенности кинетики, позволяющие объединить их в отдельный класс.
Скорость топохимической реакции определяется числом зародышей и скоростью их роста, т.е. суммарной протяженностью реакционной зоны во всем образце в каждый данный момент времени.
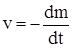 ,
,
где m – изменение массы исходного твердого вещества. Если речь идет о реакции между двумя и более твердыми веществами, то под dm понимают изменение массы реагента, взятого в недостатке против стехиометрии реакции.
Здесь концентрация теряет смысл, о скорости протекания реакции судят по изменению степени превращения α исходного вещества (уравнение 41).
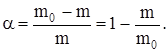
Отсюда m=m0(1 – α); dm=m0dα.
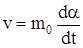 , или
, или 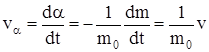 , где vα – скорость реакции, нормированная на единицу исходной массы.
, где vα – скорость реакции, нормированная на единицу исходной массы.
Скорость топохимической реакции зависит от давления газообразных компонентов, температуры и является функцией времени или глубины протекания реакции:
v = v(p, T, t), vα = v(p, T, α).
Считается, что реакция начинается в отдельных точках твердого тела - так называемых зародышах ядер, которые называются потенциальными центрами реакции. Ими могут быть дефекты кристаллической решетки, выходящие на поверхность (дислокации, вакансии, частицы в междоузлиях и т.п.). Им свойственна повышенная свободная энергия, и, следовательно, повышенная реакционная способность.
На потенциальных центрах образуются зародыши новой фазы - ядра и начинается рост ядер. Ядра разрастаются и искажают материнскую решетку, что еще более увеличивает свободную энергию решетки вокруг ядра и реакция ускоряется, как из-за увеличения площади контактной поверхности, так и из-за искажения. Когда ядра сливаются, наблюдается максимум скорости реакции.
Далее наступает замедление, связанное с уменьшением площади контакта за счет уменьшения объема исходного вещества. Реальная картина может быть значительно сложнее, например, из-за растрескивания кристаллов вследствие большого различия удельных объемов исходного вещества и продукта.
Кривая α = f(t) являются частными случаями так называемой обобщенной кинетической кривой (рис. 5)  , которая имеет следующие особенности:
, которая имеет следующие особенности:
1. Начальный период (I), относящийся к значениям степени превращения 0, 01 < α < 0, 05. Изменения на этом участке кривой могут быть обусловлены либо десорбцией газа, либо термическим разложением нескольких атомных слоев, прилегающих к поверхности твердого реагента.
2. Участок II – период индукции, в течение которого протекание реакции весьма ограниченно. Но после достижения критического времени t0 скорость реакции быстро возрастает в период ускорения (III), чтобы достичь своего максимального значения в точке перегиба (α i; ti).
3. Период спада, начинающийся при t > ti, характеризуется быстрым уменьшением скорости реакции, стремящейся к нулю в конце реакции. На этой стадии прореагировавшая часть α f может отвечать (или нет) полному превращению исходного твердого реагента.
Предполагается, что скорость реакции пропорциональна объему реакционной зоны. Для этого необходима однородность реакционной зоны по температуре и давлению. Так как плотность твердого тела мало меняется с температурой:
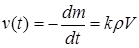
Где k – константа скорости реакции, ρ – плотность реагена, V – объем реакционной зоны (эта величина изменяется во времени).
Зона реакции локализована в переходном слое δ между исходным веществом и продуктом на поверхности раздела фаз и мало меняется по ходу реакции, поэтому
V(t) = δ s(t),
Где s(t) – реакционная поверхность раздела.
Отсюда 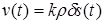 .
.
Величина 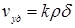 называется удельной скоростью реакции (при s=1); она остается постоянной во времени и для ее определения необходимо знать s(t).
называется удельной скоростью реакции (при s=1); она остается постоянной во времени и для ее определения необходимо знать s(t).
К определению v(t) можно подойти и с другой стороны. Мы можем представить реакцию в твердом теле как движение поверхности s(t) сквозь реагент с постоянной линейной скоростью v. Изменение массы исходного вещества за время dt, очевидно, равно dm=ps(t)vdt. Отсюда
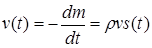
Приравняв правые части уравнения (47) и (49), найдем, что v=kδ или 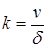 .
.
Константа скорости к (с-1) – это величина, обратная времени пребывания реагента в зоне реакции толщиной δ. Для определения k необходимо знать толщину зоны и линейную скорость ее продвижения. С другой стороны, если в эксперименте определяется линейная скорость v, то тем самым мы получаем информацию и о k. Эта информация будет тем более определенной, чем более достоверны сведения о структуре реакционной зоны. В настоящее время неизвестны методы непосредственного определения величины k, и максимум, что удается достичь, — это прямое определение линейной скорости продвижения границы v.
Как видно из уравнения (49), для определения скорости реакции нужно знать зависимость реакционной поверхности раздела s(t) от времени. Экспериментальные методы определения s(t) отсутствуют. Поэтому все способы вычисления этой величины основаны на так называемых морфологических моделях реакции.