
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Раздел 1. Тепловые эффекты химических реакций
|
|
Задание 1. Укажите, какие из нижеуказанных уравнений химических реакций являются термохимическими:
а) СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г) + 804 кДж; б) N2(r) + O2(г) → 2NO(г) -Q;
в) S + О2 = SO2; г) СаСО3(тв) = СаО(тв) + СО2(г) - 180кДж;
д) С3Н8+ 5О2 = 3СО2 + 4Н2О е) 3Н2 + N2 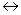 2NH3 + 92кДж;
2NH3 + 92кДж;
ж) СО(г)+С12(г) 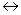 СОС12(г)+ Q; з) SO3 + Н2О = H2SO4;
СОС12(г)+ Q; з) SO3 + Н2О = H2SO4;
и) СО(г) + Н2(г) 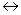 СН3ОН(ж) + 127, 8кДж.
СН3ОН(ж) + 127, 8кДж.
Из термохимических уравнений реакций выберете уравнения экзотермических реакций.
Задание 2. Термохимическое уравнение реакции имеет вид 2Н2(г) + О2(г) = 2Н2О(г) + 483, 7кДж. Укажите, эта реакция является экзотермической или эндотермической. В данной реакции энергия, которая поглотилась при разрыве связи в молекулах исходных веществ, больше или меньше энергии, которая выделилась при образовании новых связей?
Задание 3. Укажите, какие из описанных ниже процессов протекают с поглощением, а какие - с выделением энергии.
1. 1s22s22p5 +ē → 1s22s22p6; 7. К -ē → К+;
2.1s22s22p63s23p64s2 → 1s22s22P63s23p63d2; 8. F +ē → F- ;
3. NaOH(кр) → Na+(р-р) + ОН-(р-р); 9. 2О → О2;
4. Ва(ОН)2 + 2HNO3 → Ba(NO3)2 + 2Н2О; 10. Р4 → 4Р;
5. С3Н8 + О2 →;
6. Zn(тв) → Zn(ж);
| ТЕСТ | 4. |
| 1. | Укажите неверные утверждения: а) разрыв химической связи сопровождается поглощением энергии; б) образование химической связи сопровождается поглощением энергии; в) в эндотермической реакции количество энергии, затраченной на разрыв химической связи, меньше количества энергии, выделяющейся при образовании химической связи; г) положительным тепловым эффектом характеризуется экзотермическая реакция. |
| 2. | Какой из перечисленных процессов является эндотермическим: а) диссоциация молекул водорода на атомы; б) образование молекул хлора из атомов; в) образование водородных связей между молекулами этанола и воды; г) образование водородных связей между молекулами воды? |
| 3. | Тепловой эффект химической реакции зависит от: а)природы веществ, участвующих в реакции; б) температуры и давления системы; в) промежуточных стадий реакции; г) агрегатного состояния вступающих в реакцию и образующихся веществ. |
| 4. | Укажите, какими значениями температуры и давления характеризуется стандартное состояние термодинамической системы: а) 273 К (0°С) и 1 кПа б) 273К (0°С) и 101, 3 кПа в) 298К (25°С) и 101, 3 кПа г) 298К (25°С) и 101325 Па |
| 5. | На знак и величину теплового эффекта реакции не влияет: а) прочность химических связей в исходных веществах; б) прочность химических связей в продуктах реакции; в) агрегатное состояние веществ; г) присутствие катализатора. |
| 6. | В результате протекания экзотермической реакции энергия системы: а)уменьшается; б) возрастает; в) не изменяется; г) может увеличиваться, а может уменьшаться. |
| 7. | При составлении термохимических уравнений реакций необходимо указывать: а)тепловой эффект реакции; б) агрегатное состояние исходных веществ и продуктов реакции; в) объем сосуда, в котором протекает реакция; г) химическое количество (моль) исходных веществ и продуктов реакции. |
| 8. | Укажите термохимические уравнения химических реакций: а) 2К + 2Н2О = 2КОН + Н2 б) 2Си(тв) + О2(г) = 2СиО(тв) в) S(т) + O2(r) = SO2(r) + 297 кДж г) Н2(г) + I2(г) = 2HI(г) - 52 кДж |
| 9. | Укажите эндотермические уравнения химических реакций: а) СО(г) + Н2О(Г) = Н2(г)+ СО2(г) + Q; б) 3Fe2O3(T)+ CO(r) = 2Fe3O4(T)+ СО2(г)- Q; в) N2 + О2 = 2NO - 180, 8 кДж; г) SO3 + Н2О = H2SO4 + 130кДж; |