
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние давления на скорость реакции
|
|
Влияние давления на скорость протекания реакции зависит от порядка реакции. Если температура остается неизменной и задан состав исходной газовой смеси, то по уравнению состояния для каждой из концентраций можно написать: pа = aR m T, pb = bR m T. Здесь а, b, …, - молярные концентрации, а pа, pb,..., - парциальные давления соответствующих газов. Если общее число молей в единице объема есть z, то точно таким же образом можно написать p = zR m T, где р - общее давление. Отсюда 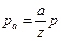 ,
, 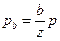 , …и т.д. Величины
, …и т.д. Величины 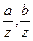 ... и т.д. есть относительные объемные концентрации. Обозначая их через А, В... и т.д., получим: pa = Ap,
... и т.д. есть относительные объемные концентрации. Обозначая их через А, В... и т.д., получим: pa = Ap,
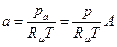 , где
, где 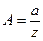 ; pb=Bp,
; pb=Bp, 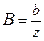 . Рассмотрим мономолекулярный процесс, описываемый уравнением:
. Рассмотрим мономолекулярный процесс, описываемый уравнением:
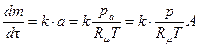 ,
,
в этом случае скорость превращения вещества прямо пропорциональна давлению: 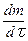 ~ p.
~ p.
Для бимолекулярной реакции:
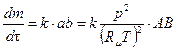 ,
,
т.е 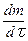 ~ p 2. Соответственно для тримолекулярной реакции получим:
~ p 2. Соответственно для тримолекулярной реакции получим:
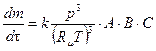 ,
,
где k - константа скорости реакции.
2.2. Энергия активации. Закон Аррениуса
Количество взаимных соударений реагирующих молекул растет ~ 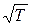 , что способствует росту скорости реакции. Например, для многих реакций увеличение температуры всего на 10°С приводит к увеличению константы скорости в 2¸ 4 раза.
, что способствует росту скорости реакции. Например, для многих реакций увеличение температуры всего на 10°С приводит к увеличению константы скорости в 2¸ 4 раза.
Пример. Время полураспада йодистого водорода по уравнению 2HJ→ Н2+J2. При Т = 373К время полураспада составляет 314000лет, при Т =666К оно уменьшается до 1, 3часа, а при Т =973К t 1/2= 0, 12сек.
Аррениус: для совершения химической реакции необходимо предварительное ослабление или разрыв внутренних связей стабильной молекулы, для чего необходимо затратить некоторое количество энергии Е. Чем больше тепловая энергия соударяющихся молекул, тем больше вероятность перестройки внутренних связей и создания новых молекул. При Е = const частота соударений, заканчивающихся реакцией, будет расти значительно быстрее, чем 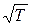 .
.
Энергия, необходимая для преодоления энергетического барьера, препятствующего сближению реагирующих молекул и образованию продуктов реакции, называется энергией активации Еa. Таким образом, элементарный акт химической реакции происходит лишь при столкновении тех молекул, кинетическая энергия которых больше Еa.
Энергия активации Eа обычно выше средней энергии теплового движения молекул. Чем ниже энергия активации, тем чаще будут происходить столкновения молекул, приводящие к образованию продуктов реакции, тем выше будет скорость химической реакции. Увеличение Т приводит к увеличению числа молекул, обладающих избыточной энергией, превышающих Eа. Этим и объясняется увеличение скорости химической реакции при возрастании температуры (рис. 2.1).

Рис. 2.1. Теплота горения Q и энергия активации Е = u max- u 1
В наиболее простых случаях константы скоростей химических реакций могут быть определены на основании общих соотношений молекулярно-кинетической теории (см., например, [6, 10]).
Обозначим через пА и пв количества молекул А и В в 1см3. Скорость реакции будет равна числу Z таких соударений молекул А и В в единицу времени, энергия которых больше энергии активации Е. Для идеального газа Z определяется на основании закона распределения энергий Максвелла – Больцмана:
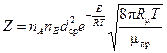 . (2.11)
. (2.11)
Здесь 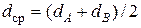 - средний эффективный диаметр сталкивающихся молекул,
- средний эффективный диаметр сталкивающихся молекул,  - приведенный молекулярный вес, R m = 8, 315∙ 107эрг/град - универсальная газовая постоянная, mА, mВ - молекулярные веса.
- приведенный молекулярный вес, R m = 8, 315∙ 107эрг/град - универсальная газовая постоянная, mА, mВ - молекулярные веса.
В большинстве случаев экспериментальные величины получаются значительно меньше теоретических. Поэтому в расчетную формулу вводят так называемый вероятностный или стерический коэффициент Р. В результате формула для расчета скорости бимолекулярной реакции, называемая формулой Аррениуса, принимает следующий вид:
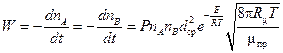 . (2.12)
. (2.12)
Сравнивая полученную формулу с уравнением (2.8) реакций второго порядка, можно получить выражение для константы скорости этой реакции:
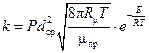 . (2.13)
. (2.13)
Сильное влияние температуры на скорость реакции объясняется в основном фактором Аррениуса 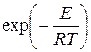 . Поэтому при приближенных расчетах предэкспоненциальный множитель часто принимают не зависящим от Т.
. Поэтому при приближенных расчетах предэкспоненциальный множитель часто принимают не зависящим от Т.
Анализ формулы (2.12) показывает, что с ростом Т темп роста W сначала увеличивается, достигает некоторой максимальной величины, а затем уменьшается, другими словами, кривая W по T имеет точку перегиба. Приравнивая нулю вторую производную от W по Т, найдем температуру, соответствующую точке перегиба:
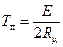 .
.
Легко видеть, что эта температура достаточно высока. Например, при Е=20000кал/(г-моль) Тп=5000К. При использовании формулы (2.12) для численных расчетов следует учитывать размерности входящих в нее величин.
Формулу (2.12) можно написать в таком виде:
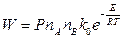 , (2.14)
, (2.14)
где 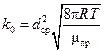 - предэкспоненциальный множитель, т.е. общее количество соударений при nA=nB=1молекула/см3. Иногда Р также включают в предэкспоненциальный множитель.
- предэкспоненциальный множитель, т.е. общее количество соударений при nA=nB=1молекула/см3. Иногда Р также включают в предэкспоненциальный множитель.
Для оценочных расчетов порядка скорости реакции величину k 0 можно принимать для температуры Т =300К равной 10-10см3/(молекула∙ сек) (для dср»4∙ 10-8 и mА=mВ»30).