
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая кинетика. Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на
|
|
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Различают среднюю скорость 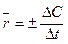 , когда изменение концентрации учитывается за конечный промежуток времени, и истинную
, когда изменение концентрации учитывается за конечный промежуток времени, и истинную 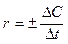 , когда за бесконечно малый промежуток времени. Знак «+» принимается для продуктов реакции, а «-» для исходных веществ.
, когда за бесконечно малый промежуток времени. Знак «+» принимается для продуктов реакции, а «-» для исходных веществ.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит закон действия масс:
Скорость химической реакции
n1A1+n1A1+n1A1+...→ продукты реакции
прямо пропорциональна произведению концентраций С1, С2,... реагирующих веществ, взятых в некоторых степенях n1, n2, …:
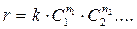 , (1)
, (1)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции это частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (n1 + n2 +...) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
Элементарными (простыми) называют реакции, идущие в одну стадию. Их принято классифицировать по молекулярности – числу частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
I2 ® I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН ® СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО ® 2NО2
Реакции с молекулярностью более трех неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Тем не менее, никакой четко определенной взаимосвязи между понятиями молекулярности и порядка реакции не существует, поскольку порядок реакции характеризует кинетическое уравнение реакции, а молекулярность – механизм реакции.
При С1=С2=…= 1, k = r, т.е. константа скорости есть скорость данной реакции при данной температуре и при единичных концентрациях всех реагирующих веществ. Скорости прямой и обратной реакций при равновесии равны, а отношение констант прямой k1 и обратной k-1 скоростей при этом отвечает константе равновесия
 . (2)
. (2)
Третьей важнейшей кинетической характеристикой является порядок реакции. Это есть суммарный показатель степени в опытном уравнении, определяющим зависимость скорости от концентрации реагентов. В общем случае порядок не совпадает с молекулярностью, поскольку он отражает не стехиометрические соотношения, в которых протекает суммарное взаимодействие (это определяет молекулярность реакции), а фактически механизм процесса в конкретных условиях. Поэтому в отличие от молекулярности, которая всегда выражается целым числом и не может равняться нулю, порядок может выражаться дробным числом или равняться нулю. Порядок выше второго практически не встречается, так как одновременно столкновение трех и более частиц маловероятно.
Рассмотрим характеристики реакций 1-го и 2-го порядков.
Реакции 1-го порядка. Если объем системы постоянен, то скорость реакции определяется по уравнению
 . (3)
. (3)
После интегрирования выражения (7) по времени от 0 до t и по концентрации от C0 до C получим:
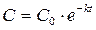 , (4)
, (4)
или, если через x обозначить количество вещества, прореагировавшего к моменту t, то С0 – С = x или
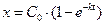 . (5)
. (5)
Найдем период полураспада, т.е. время, за которое исходное вещество прореагирует ровно наполовину, для реакции первого порядка t1/2.
Из (8) следует, что:  , а для периода полураспада
, а для периода полураспада 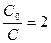 , отсюда получаем, что
, отсюда получаем, что
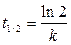 . (6)
. (6)
Из изложенного следует, что для реакции 1 -го порядка числовая величина константы скорости не зависит от выбора единиц концентрации и определяется только выбором единиц времени 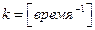 , а период полураспада не зависит от начальной концентрации вещества.
, а период полураспада не зависит от начальной концентрации вещества.
Реакции 2-го порядка. В простейшем случае 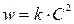 , когда исходные вещества взяты в эквимолярном соотношении), кинетическое уравнение отображается следующим выражением
, когда исходные вещества взяты в эквимолярном соотношении), кинетическое уравнение отображается следующим выражением
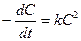 (7)
(7)
или 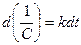 . После интегрирования выражения (11) по времени в пределах от 0 до t и соответственно по концентрации от C0 до C получим:
. После интегрирования выражения (11) по времени в пределах от 0 до t и соответственно по концентрации от C0 до C получим:
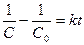 (8)
(8)
или, вводя x:
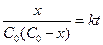 . (9)
. (9)
Период полураспада, соответствующий 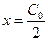 , для таких реакций равен
, для таких реакций равен
 . (10)
. (10)
Из (14) следует, что числовая величина константы скорости реакций второго порядка определяется выбором единиц концентрации  , а период полураспада для реакции второго порядка зависит от начальной концентрации. Подобные соотношения справедливы и для реакций выше 2 -го порядка.
, а период полураспада для реакции второго порядка зависит от начальной концентрации. Подобные соотношения справедливы и для реакций выше 2 -го порядка.